| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
COVID-19
| Klassifikation nach ICD-10 | ||
|---|---|---|
| U07.1 | COVID-19 | |
| ICD-10 online (WHO-Version 2013) | ||
COVID-19 (für englisch coronavirus disease 2019 ‚Coronavirus-Krankheit 2019‘) ist eine durch das Coronavirus SARS-CoV-2 verursachte Viruserkrankung. Sie wurde erstmals 2019 in Wuhan beschrieben (siehe COVID-19-Pandemie) und verbreitet sich hauptsächlich durch Tröpfcheninfektion. Theoretisch ist auch eine Schmierinfektion oder Ansteckung über die Bindehaut der Augen möglich.[1]
Die Krankheitsverläufe sind unspezifisch, vielfältig und variieren stark. Neben symptomlosen Infektionen wurden überwiegend milde bis moderate Verläufe beobachtet, jedoch auch schwere als beidseitige Lungenentzündung bis hin zu Lungenversagen und Tod.[1] Ob auch als leicht beschriebene Krankheitsverläufe langfristige Schäden zur Folge haben können, kann bisher nicht ausgeschlossen werden.[2][3] Bei COVID-19 ist die Forschung aktuell sehr dynamisch. Aufgrund der Neuartigkeit der Erkrankung wird oftmals auf vorläufig akzeptierte Studien zurückgegriffen.
Bei rund 81 % der registrierten Infizierten verläuft die Krankheit nur mit Fieber oder einer leichten Lungenentzündung; bei etwa 14 % der Fälle verläuft sie schwerer, und in etwa 5 % so schwer, dass eine intensivstationäre Betreuung notwendig und der Zustand kritisch bzw. lebensbedrohlich ist.[4][5] Da eine hohe Zahl der Ansteckungen auch asymptomatisch verlaufen kann (z. B. gut die Hälfte der Fälle auf der Diamond Princess;[6] Manifestationsindex 51 – 81 %[1]) und daher unentdeckt bleibt, sind diese Zahlen nicht abschließend.[7] Die Inkubationszeit beträgt durchschnittlich fünf bis sechs Tage; es können aber zwischen der Infektion mit dem Krankheitserreger und dem Auftreten erster Symptome auch bis zu zwei Wochen vergehen.[1] Bei einem leichten Krankheitsverlauf klingen die Krankheitszeichen, sofern überhaupt welche bestehen, laut WHO in der Regel innerhalb von zwei Wochen ab.[8] Bei einem schweren Krankheitsverlauf dauere es drei bis sechs Wochen, bis die Erkrankten sich erholen.[8]
Ursache und Krankheitsentstehung
Auslöser der Erkrankung ist das Betacoronavirus SARS-CoV-2, das erstmals im Januar 2020 aufgrund von Isolaten aus Pneumoniepatienten identifiziert wurde.[9]
Übertragungsweg
Am 20. Januar 2020 gab die chinesische Gesundheitskommission bekannt, dass eine Mensch-zu-Mensch-Übertragung möglich sei,[10][11] insbesondere wenn zwei Personen engen Kontakt zueinander haben (weniger als 1,8 m Abstand).[12] Es wird angenommen, dass sich das Virus wie andere Erreger von Atemwegserkrankungen durch Tröpfcheninfektion verbreitet.[12][13][14] Vorläufige Untersuchungen zeigen, dass das Virus auf Kunststoff und rostfreiem Stahl bis zu drei Tage lebensfähig bleiben kann, jedoch nicht länger als einen Tag auf Pappe oder länger als vier Stunden auf Kupfer überlebt. Die Tests besagen, dass die Viren in Aerosolen, die beim Husten oder Niesen entstehen, wenigstens drei Stunden lang lebensfähig bleiben und Menschen infizieren können. Die Halbwertszeit beträgt nach den Untersuchungen etwa 66 Minuten, bis die Hälfte der Viren ihre Funktion in Aerosolen verlieren.[15] [16]
Das Virus wurde bisher im Sekret des Nasen- und Rachenraumes, im Sputum, dem Stuhl und dem Blut nachgewiesen.[17][18] Chinesische Forscher schließen aufgrund von quantitativen Analysen von RT-PCR-Untersuchungen des Nasenrachenraums, dass das Virus wie Influenza auch durch Aerosole übertragbar ist.[19][20] Eine Studie der US-amerikanischen NIH erhärtete diese Ansicht anhand quantitativer Viruslastbestimmung in Aerosolen. Die Halbwertszeit des Virus in aerosolierter Form entsprach in dem experimentellen Ansatz rund einer Stunde.[21] Bei 17 untersuchten Patienten mit Krankheitssymptomen war die Virenmenge in der Nase höher als im Rachen; das Auftreten gerade in den oberen Atemwegen unterscheidet SARS-CoV-2 damit von dem SARS-verursachenden Virus.[19]
Bei drei von 63 Patienten mit COVID-19-Pneumonie waren Abstriche von den Augenbindehäuten PCR-positiv.[22] Obgleich die Studie nicht eindeutig belegt, dass die Bindehaut als Viren-Eintrittspforte fungieren kann, rät das Robert Koch-Institut (RKI), präventiv davon auszugehen.[1] In einer vorläufigen Tierstudie konnte ein Rhesusaffe über die Augenbindehäute mit SARS-CoV-2 infiziert werden. Das auf diesem Weg infizierte Tier wies im Vergleich zu einem intratrachlear infizierten eine höhere Viruslast in Nase, Auge und Tränengang, aber eine geringere Viruslast in der Lunge auf.[23]
Ob eine Übertragung auch durch das Berühren kontaminierter Oberflächen und Gegenstände stattfindet, ist unklar.[12] Eine Auswertung von 22 Studien, die sich mit der Persistenz von medizinisch relevanten Coronaviren (wie SARS-CoV und MERS-CoV) auf Oberflächen beschäftigen, zeigt, dass diese Viren bei Raumtemperatur bis zu neun Tage lang auf Oberflächen aus Metall, Glas oder Plastik überdauern können. Durchschnittlich bleiben sie vier bis fünf Tage infektiös. Allerdings können sie durch geeignete Desinfektionsmittel inaktiviert werden (vergleiche Abschnitt Hygienemaßnahmen). Nach Aussage der beteiligten Wissenschaftler sollten diese Erkenntnisse auf SARS-CoV-2 übertragbar sein.[24][25]
Aufgrund von quantitativen Virusuntersuchungen im Sekret des Nasenrachenraums bei Patienten mit sehr leichten Symptomen schlossen die Forscher der Virologie der Charité und des Instituts für Mikrobiologie der Bundeswehr, dass auch bereits bei sehr milden Erkrankungssymptomen eine hohe Infektionsfähigkeit besteht.[26][27] Auch das Robert Koch-Institut berichtet über einzelne Fälle, bei denen sich Betroffene möglicherweise bei infizierten Personen angesteckt haben, die noch keine oder keine spezifischen Symptome gezeigt hatten.[14] Eine Analyse von Infektionen in Singapur und Tianjin in China ergab, dass viele Infektionen von Menschen übertragen wurden, die mit dem Virus infiziert waren, aber noch keine Symptome zeigten.[28]
Anteil bestimmter Bevölkerungsgruppen
Eine Mitte Februar 2020 veröffentlichte Auswertung der englischsprachigen und chinesischen Fachartikel kommt zu dem Ergebnis, dass alle Bevölkerungsgruppen infiziert werden können. Von den Infizierten waren 72 % über 40 Jahre alt, 64 % waren männlich. 40 % der Patienten hatten chronische Erkrankungen wie Diabetes mellitus und Bluthochdruck.[11]
Das RKI gibt für Deutschland (Stand 18. März 2020) ein Geschlechterverhältnis von 56 % männlichen und 44 % weiblichen Erkrankten an. Im Hinblick auf die Altersverteilung liegt der Median bei 47 Jahren; 80 % der Erkrankten sind 15–59 Jahre alt, 16,3 % sind 60 Jahre oder älter, 2,4 % sind 5–14 Jahre alt und 0,8 % jünger als 5 Jahre.[1]
Ein Bericht des Centers for Disease Control and Prevention zur Altersverteilung in den USA kam zu dem Schluss, dass schwere Verläufe, die eine Hospitalisierung oder intensivmedizinische Versorgung erfordern, bei Erwachsenen jedes Alters auftreten können. Zwar seien besonders Ältere betroffen, allerdings waren 20 % der Hospitalisierten und 12 % der intensivmedizinisch Behandelten des untersuchten Kollektivs 20–44 Jahre alt. Unter 20-Jährige zeigten hingegen so gut wie keine schweren Verläufe.[29]
Eine Studie an Kindern aus Wuhan stellte eine bestätigte Infektion bei 171 von 1391 untersuchten Kindern fest. Nur eine Minderheit der Kinder zeigte Fieber oder andere Symptome. Von den infizierten Kindern verstarb ein 10 Monate alter Säugling, der auch an einer Invagination litt. Die Studienautoren werteten die Ergebnisse als einen Hinweis auf einen milderen Verlauf bei Kindern und wiesen auf die Möglichkeit der Übertragung der Erkrankung durch Kinder mit wenig Krankheitszeichen hin.[30]
Inkubationszeit
Die Inkubationszeit kann laut Informationen des Robert Koch-Instituts (RKI) bis zu 14 Tage betragen.[14] Darüber hinaus gibt es Berichte chinesischer Forscher, welche die mögliche Inkubationszeit auf bis zu 24 Tage ausdehnen.[31] Eine Analyse der ersten 425 in Wuhan gemeldeten Fälle ergibt eine Inkubationszeit von im Mittel 5,2 Tagen und ein Durchschnittsalter von 59 Jahren. Die Autoren gehen davon aus, dass bereits Mitte Dezember 2019 im Umfeld des Fischmarktes Übertragungen von Mensch zu Mensch stattfanden.[32] Eine statistische Auswertung mehrerer Berichte von Infektionen in einem Haushalt oder in anderer enger räumlicher Begrenzung (sogenannte Cluster) ergibt eine Inkubationszeit von im Median 5–6 Tagen.[33]
Eine Ansteckung anderer Menschen während der Inkubationszeit ist trotz beschwerdefreien Gesundheitszustands möglich. Tests auf die Viruslast im Sputum bei einzelnen Patienten legen den Verdacht nahe, dass manche Patienten auch während der Ausheilung bei klinischer Besserung weiterhin vorübergehend infektiös sein können.[34] Der Bericht dieser Publikation, welcher auf der Annahme einer asymptomatischen chinesischen Indexpatientin beruhen, wurde durch die Recherche der Fachzeitschrift Science widerlegt und vom RKI in Zweifel gezogen.[35] In einer Gruppe von 126 aus Wuhan nach Deutschland Evakuierten zeigten sich zwei Patienten in der RT-PCR des Rachenabstrichs positiv, welche keine oder nur sehr unspezifische Beschwerden aufwiesen.[36] Ebenso ist ein Fall eines subjektiv asymptomatischen zehnjährigen Jungen in Shenzhen beschrieben, dessen Blutbild und Entzündungszeichen im Labor unauffällig waren. In der weiteren Untersuchung zeigten sich jedoch radiologische Befunde vereinbar mit einer Pneumonie, und im Rachenabstrich ließ sich Virus-RNA nachweisen.[17]
Darüber hinaus existiert ein weiterer Fallbericht aus Guangzhou von zwei asymptomatisch Infizierten mit Virusnachweis im Nasenrachenraum. Die Autoren wiesen explizit auf die Verbreitungsgefahr des Virus durch beschwerdefreie Patienten in frühen Infektionsstadien hin.[37] Messungen der Viruslast im Sekret des Nasenrachenraums ergeben eine ähnlich hohe Viruslast zwischen beschwerdefreien und symptomatisch kranken Patienten.[19] Aufgrund von quantitativen Virusuntersuchungen im Sekret des Nasenrachenraums bei Patienten mit sehr leichten Symptomen schlossen die Forscher der Virologie der Charité und des Instituts für Mikrobiologie der Bundeswehr, dass auch bereits bei sehr milden Erkrankungssymptomen eine hohe Infektionsfähigkeit besteht.[26][27] Auch das Robert Koch-Institut berichtet über einzelne Fälle, bei denen sich Betroffene möglicherweise bei infizierten Personen angesteckt haben, die noch keine oder keine spezifischen Symptome gezeigt hatten.[14] Zum gleichen Ergebnis kommt eine chinesische Fallstudie, die sechs Patienten einer Familie betrachtet. Patientin 1 hat ihre fünf Verwandten mit SARS-CoV-2 angesteckt, ohne selbst Symptome zu zeigen. Wegen der Krankheitsfälle in der Familie wurde auch sie isoliert und ärztlich überwacht. Der Virusnachweis durch RT-PCR bei ihr war nach 17 Tagen negativ, nach 19 Tagen positiv und nach 25 bzw. 30 Tagen wieder negativ.[31] In einer Studie an 191 Krankenhauspatienten zeigten chinesische Forscher bei den 137 Überlebenden ein positives Testergebnis der RT-PCR für im Mittel zwanzig Tage mit einer Streuung zwischen acht und 37 Tagen.[38]
Es sind mehrere Patienten nachgewiesen, die nach klinischer Ausheilung und negativer PCR-Testung erneut eine nachweisbare Viruslast entwickelten. Ob es sich um eine Wiederinfektion oder eine Reaktivierung des Virus handelt ist unklar.[39] Eine Reinfektion bei den speziell aus Japan berichteten Fällen wird von führenden Virologen mittlerweile stark bezweifelt.[40]
Pathogenese
Das COVID-19 auslösende Virus SARS-CoV-2 dringt wie das SARS-assoziierte Coronavirus bei SARS über den ACE2-Rezeptor in die menschliche Zelle ein.[41] Dabei interagiert das virale Spike-Protein mit dem ACE2-Rezeptor. Für diesen Prozess ist die Mitwirkung der Serinprotease TMPRSS2 notwendig.[42]
Da ein Großteil der ACE-2 exprimierenden Zellen des Menschen in den Pneumozyt Typ II-Zellen der Lunge vorkommt[43], werden diese Zellen als Reservoir für SARS-CoV-2 vermutet.[44] Als weitere Gründe für die besondere Vulnerabilität der Lunge wird ihre große Oberfläche angegeben[44], außerdem verfügen die ACE-2 exprimierenden Pneumozyt Typ II-Zellen über diverse Gene, die die Replikation und Transmission von SARS-CoV-2 begünstigen.[43]
Im Versuch mit HeLa-Zellen, die ACE2 des Menschen, der Chinesischen Hufeisennase (Rhinolophus sinicus), einer Schleichkatzenart (englisch civet), des Hausschweins und der Maus exprimieren, konnte SARS-CoV-2 das jeweilige ACE2-Protein als Rezeptor nutzen, um in die Zelle einzudringen, nur bei dem Maus-ACE2 gelang dies nicht, ebenso wenig bei HeLa-Zellen, die kein ACE2 bildeten. An Rezeptoren, die von anderen Coronaviren genutzt werden, findet keine Bindung von SARS-CoV-2 statt.[41]
Klinische Symptome und laborchemische Krankheitszeichen
| Symptome (Quelle: WHO)[45] | Häufigkeit |
|---|---|
| Fieber | 87,9 % |
| Trockener Husten | 67,7 % |
| Unwohlsein und Ermüdung | 38,1 % |
| Erhöhte Speichelproduktion | 33,4 % |
| Kurzatmigkeit | 18,6 % |
| Muskel- oder Gelenkschmerz | 14,8 % |
| Halsschmerzen | 13,9 % |
| Kopfschmerz | 13,6 % |
| Schüttelfrost | 11,4 % |
| Übelkeit/Erbrechen | 5,0 % |
| Schnupfen | 4,8 % |
| Durchfall | 3,7 % |
| Hämoptyse | 0,9 % |
| Chemosis | 0,8 % |
Da dieser Virustyp erst im Januar 2020 nachgewiesen wurde, ändern sich die Erkenntnisse über die Krankheit möglicherweise noch.
Eine Abgrenzung von anderen Viruserkrankungen wie Influenza ist schwierig. Nach einer Inkubationszeit von bis zu 14 Tagen[46] können Fieber, Muskelschmerzen und trockener Husten auftreten. Häufig manifestiert sich die Krankheit auch mit allgemeinem, schwerem Krankheitsgefühl und auch Rückenschmerzen.[47]
Im weiteren Verlauf kann sich eine schwere Atemnot aufgrund einer Infektion der unteren Atemwege bis zur Lungenentzündung entwickeln.[48] Diese kann mit Brustschmerzen im Sinne einer Pleuritis einhergehen. Die Mehrheit der Patienten zeigte die für schwere Virusinfekte typische Kombination aus einer Verminderung der Anzahl der gesamten weißen Blutzellen, einer Verminderung der Lymphozyten-Anzahl und einer Erhöhung laborchemischer Entzündungsparameter (wie CRP und BSG). Wenige Betroffene leiden auch unter Schnupfen, Übelkeit und Durchfall.[46] Häufig scheint außerdem laut dem Virologen Hendrik Streeck ein mehrtägiger Geschmacks- und Geruchsverlust bei fortgeschrittenem Krankheitsverlauf aufzutreten.[49]
Im Bericht der chinesischen Seuchenschutzbehörde CCDC erfolgt die Klassifizierung als leichter Krankheitsverlauf, wenn keine oder nur eine leichte Lungenentzündung vorliegt, für einen schweren Krankheitsverlauf sind Pneumonie (Lungenentzündung), Dyspnoe (Atemnot), eine Atemfrequenz von ≥ 30 Atemzüge pro Minute, eine Sauerstoffsättigung des Blutes ≤ 93 % und weitere klinische Anzeichen typisch, bei einem kritischen Krankheitsverlauf ist mit Atemversagen, septischem Schock und/oder Multiorganversagen zu rechnen.[4]
Die Mehrheit der Krankenhauseinweisungen der ersten Patienten erfolgte nach rund einwöchiger symptomatischer Krankheit aufgrund einer Verschlechterung des Zustandes. In den Fällen, in denen eine intensivmedizinische Behandlung notwendig wurde, ergab sich deren Notwendigkeit nach rund zehn Tagen nach Symptombeginn.[48] In einer epidemiologischen Studie von 99 hospitalisierten Fällen fanden bei 13 Patienten eine nicht-invasive Beatmung, bei vier Patienten eine invasive Beatmung, bei neun Patienten eine Dialyse aufgrund eines Nierenversagens und bei drei Patienten eine extrakorporale Lungenunterstützung (ECMO) Anwendung.[50]
Ein wesentlicher Unterschied zum SARS-Coronavirus ist, dass Patienten schon einige Tage vor Einsetzen der Krankheitssymptome infektiös sein können (beim SARS-Coronavirus waren die Patienten hingegen erst nach Auftreten der Symptome infektiös). Die Infektion lässt sich daher schwerer erkennen und schwieriger eindämmen. Bei Quarantänemaßnahmen reicht es deswegen nicht aus, nur die klinisch auffälligen Personen zu isolieren.[51]
Lymphopenie und Zytokinsturm
Etwa 85 % der schwer erkrankten Covid-19-Patienten entwickeln eine Lymphopenie, das heißt einen Mangel an Lymphozyten im Blut.[52] Bei tödlich verlaufenden Erkrankungen kam es zu einer anhaltenden Lymphopenie. Die schwer erkrankten Patienten entwickeln häufig zudem eine Hyperzytokinämie (Zytokinsturm). Ein Zytokinsturm (engl. cytokine storm) entsteht durch eine Überreaktion des Immunsystems. Diese Überreaktion ist durch enen deutlichen Anstieg von entzündungsrelevanten Zytokinen wie beispielsweise Interleukin-6, Interleukin-8, Interleukin-1β und TNF-α gekennzeichnet. Die verstärkte Freisetzung dieser Zytokine führt zu einer Überproduktion von Immunzellen, vor allem im Lungengewebe. Dort werden von den Immunzellen weitere Zytokine ausgeschüttet (Mitkopplung). Diese unkontrollierte Immunantwort führt zu schweren entzündlichen Erkrankungen wie beispielsweise Lungenentzündung, Atemnot und Entzündungen der Atemwege.[53][54]
Zytokinsturm und Lymphopenie werden als „lymphopenische ambulant erworbene Pneumonie“ (engl. lymphopenic community acquired pneumonia, L-CAP) zusammengefasst. L-CAP ist mit schwerem Krankheitsverlauf, erhöhter Sterblichkeit und fehlgesteuerter Immunantwort verbunden. Man geht davon aus, dass eine frühzeitige Erkennung dieses immunologischen Phänotyps nützlich sein könnte, um Patienten mit schweren Verläufen rechtzeitig identifizieren zu können.[55]
Krankheitsverlauf bzw. Dauer der Erkrankung
Die Auswertung von 44.415 Fällen durch die CCDC zeigt bei 81 % der bestätigten Fälle einen leichten, bei 14 % einen schweren und bei 5 % einen kritischen Krankheitsverlauf.[4] Bei einem leichten Krankheitsverlauf klingen die Krankheitszeichen, sofern überhaupt welche bestehen, laut WHO in der Regel innerhalb von zwei Wochen ab.[56] Bei Menschen mit einem schweren Krankheitsverlauf dauere es zwischen drei und sechs Wochen, bis sie sich von der Krankheit erholen.[56]
Diagnostik
Virus- und Antikörpernachweis
RT-PCR
Die Nachweismethode ist die real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion (abgekürzt als qRT-PCR oder RT-qPCR). Sie basiert auf der Detektion von zwei Nukleotidsequenzen, bezeichnet als E Gen und RdRp Gen.
Die Wahrscheinlichkeit des Tests einen Kranken auch korrekt als krank zu erkennen hängt stark von der Entnahmeart des Materials ab. Der wegen seiner einfachen Durchführbarkeit meist durchgeführte Abstrich des Nasenrachens zeigte in einer kleinen chinesischen Studie eine Sensitivität von 63 %. Die Entnahme von Material mittels einer Lungenspiegelung erkannte das Virus in 93 % der Krankheitsfälle.[57]
Weitere Nachweismethoden
Das Virus kann auch durch eine Genomanalyse (RNA-Sequenzierung des Genoms) identifiziert werden.[58] Die NAAT-Methode (Nucleic Acid Amplification Technology) beruht ebenfalls auf der RT-PCR, das fertig zusammengestellte Assay bietet jedoch den Vorteil, einfacher in der Handhabung zu sein und lässt sich von entsprechend ausgestatteten Routine-Laboratorien verwenden.[58] Seit Februar 2020 gibt es ein derartiges Assay (test kit) mit der Bezeichnung Centers for Disease Control and Prevention (CDC) 2019-Novel Coronavirus (2019-nCoV) Real-Time Reverse Transcriptase (RT)-PCR Diagnostic Panel.[59] Weiterhin wird der Antikörpernachweis als serologische Untersuchung nach Angabe der WHO derzeit entwickelt (Stand: 17. Januar 2020).
Antikörpertest Mittlerweile liegt ein vorläufiger Bericht über einen Antikörpertest vor. Dieser Test weist Antikörper gegen das Virus nach und kann als Marker der Ausheilung sowie einer durchgemachten Infektionen mit Immunität dienen.[60]
Bildgebende Verfahren
Ob ein Mensch mit dem Virus infiziert ist, lässt sich durch die Bildgebung nicht feststellen. Jedoch lassen sich bei Patienten, deren Krankheit so schwer ist, dass sie eine Lungenentzündung hervorruft, diese bildgebend nachweisen. In der Bildgebung zeigen sich im CT milchglasartige Verdickungen wie sie auch bei anderen viralen Lungenentzündungen vorkommen.[61] Diese Veränderungen lassen sich auch aufgrund ihrer oft pleuranahen Lage auch sonographisch darstellen.[62]
In Zeiten einer Epidemie ist die Diagnostik COVID-19-typischer Lungenschäden mittels Bildgebung der Diagnostik per RT-PCR überlegen, da die CT-Bildgebung schneller erfolgen kann und die Veränderungen zuverlässiger entdeckt werden als der fehleranfällige Abstrichtest. Bei einem gehäuften Auftreten der Patienten kann es sinnvoll sein, Verdachtsfälle mit typischer Bildgebung auch bei negativer RT-PCR wie COVID-19-Fälle zu behandeln, um die Einleitung einer Therapie nicht zu verzögern.[63][64]
Behandlung
Derzeit steht keine spezifische Behandlung zur Verfügung, allenfalls können Symptome gelindert werden; möglicherweise sind aber einige bereits existierende Virostatika, die zum Beispiel gegen MERS-CoV und HIV eingesetzt werden, auch bei einer Infektion mit SARS-CoV-2 wirksam.[65][66][67] Dazu gehören Proteasehemmer wie Indinavir, Saquinavir, Lopinavir/Ritonavir und Interferon-beta[68][69] sowie der RNA-Polymerasehemmer Remdesivir.
Die Nationale Gesundheitskommission der VR China empfiehlt eine Kombination der HIV-Proteaseinhibitoren Lopinavir und Ritonavir mit inhalativ verabreichtem Interferon Alpha. In den Vereinigten Staaten wurde im Rahmen des Compassionate-Use-Protokolls das Nukleotidanalogon Remdesivir eingesetzt, das eigentlich gegen Ebolafieber entwickelt wurde. Ein Wirkungsnachweis steht noch aus.[70] Außerdem wurde bereits unmittelbar nach Veröffentlichung der RNA-Sequenz des Virus in mehreren Laboren damit begonnen, einen Impfstoff gegen das Virus zu entwickeln.[71]
Eine randomisiert-kontrollierte Studie an 199 Patienten in China zeigte keinen Vorteil für die Patienten durch die Gabe von Lopinavir/Ritonavir.[72] Auch Fallberichte über die Behandlung mit Oseltamivir berichten von keiner erkennbaren antiviralen Wirkung.[73]
Neben Remdesivir sind in China zurzeit noch Favipiravir und Chloroquin, ein Wirkstoff gegen Malaria, in der Erprobung am Menschen.[74] Die klinischen Studien für Remdesivir finden in China und weiteren Staaten statt, Favipiravir – ein Wirkstoff, der unter anderem gegen das Influenzavirus verwendet wird – wird an 70 Patienten in Shenzhen erprobt und hat am 16. Februar 2020 kurzfristig als wirksames Virustatikum für fünf Jahre unter dem Namen Favilavir die Zulassung für China erhalten und wird ab sofort produziert.[75] Laut chinesischen Medienberichten, welche sich auf den Direktor des Nationalen Biotechnologiezentrums Zhang Xinmin berufen, zeige Favipiravir einen Therapievorteil im klinischen Einsatz.[76] Chloroquin zeigte erfolgversprechende Ergebnisse bei einer In-vitro-Studie in Zellkultur[77] und wurde laut einem Artikel aus China auch klinisch erfolgreich eingesetzt.[78] Eine erste klinische Studie aus Frankreich kommt zu positiven Ergebnissen[79] Chloroquin ist auch Teil der südkoreanischen Therapieleitlinien und wird dort für Patienten mit Vorerkrankungen und mittelschweren Verläufen empfohlen.[80] Ebenso wird es in den vorläufigen Therapieleitlinien für Belgien der Universität Antwerpen empfohlen.[81] Auch Luxemburg verfolgt diesen Ansatz weiter (Stand: 20. März 2020).[82][83]
Aktuell rufen die Kliniken bereits genesene Patienten zu Blutspenden auf, um mit daraus gewonnenem antikörperreichem Plasma Akutfälle zu therapieren und wertvolle Erkenntnisse zur Entwicklung eines Impfstoffes zu erhalten.[84][85] Laut chinesischen Medienberichten vom Februar 2020 wurden diese erfolgreich beim Menschen eingesetzt.[86] Im März publizierte eine deutsche Arbeitsgruppe den Nachweis einer Fremdimmunisierung bei Tieren. In derselben Studie wiesen die Forscher nach, dass das Virus die Serinprotease TMPRSS2 für das Eindringen des Virus in die Zellen über den ACE2-Rezeptor nutzt. Mit dem in Japan zugelassenen Medikament Camostat liegt ein Hemmer dieser Protease vor, der klinischen Studien unterzogen werden könnte.[87]
In einem Diagnose- und Behandlungsschema für Triagezentren aus Wuhan kommen bei Verdachtspatienten das Virostatikum Umifenovir und eine antibiotische Behandlung mit Linezolid, Nemonoxacin oder Fluorchinolonen zum Einsatz. Die antibiotische Behandlung wird mit einer zu erwartenden bakteriellen Zweitinfektion des durch den Virusinfekt geschädigten Lungengewebes begründet. Die Autoren betonen den Stellenwert des Therapiebeginns vor Eintreffen des RT-PCR-Tests aufgrund klinischer, laborchemischer und apparativer Untersuchungsbefunde. Patienten ohne Nachweis einer Verminderung der Lymphozytenzahl im Blut, ohne virale Pneumonie, ohne Dyspnoe (Atemnot) und ohne Reduktion der Sauerstoffsättigung unter <93 % sollten ohne RT-PCR-Testung in die Heimversorgung entlassen werden. Für diese Patienten ist die orale Gabe von Azithromycin oder Amoxicillin vorgesehen. Patienten mit Pneumonien anderer Genese sollen regulär und nach Möglichkeit ambulant behandelt werden. Schwangere Frauen und Menschen über 65 Jahre sollen als besondere Risikogruppen eher stationär behandelt werden. Die Studienautoren begründen ihr Vorgehen mit der Überforderung des Gesundheitswesens in Wuhan. Die Behandlung möglichst vieler Patienten zu Hause berge Risiken, sei aber notwendig, um die vielen kritischen Fälle zu versorgen.[64]
Die italienische Akademie für Thoraxultraschall hat ein umfassendes Diagnostik- und Behandlungsschema entwickelt, welches auch Triage und Eigenschutz mit einbezieht. Das Schema empfiehlt eine stationäre Aufnahme aller Patienten mit Dyspnoe und röntgenologisch oder sonographisch fassbaren Krankheitszeichen der Lunge. Ab diesem Stadium der Erkrankung wird Lopinavir/Ritonavir sowie Chloroquin empfohlen. Bei Patienten mit einem manifesten Lungenversagen wird die Gabe von Remdesivir empfohlen. Als diagnostische Methoden dienen der Abstrich in Kombination mit Thoraxultraschall, Röntgen und CT. Das Schema weist explizit auf die hohe Häufigkeit von falsch-negativen Abstrichen hin, welche weder eine weitere Diagnostik noch Therapie verzögern sollen. Bei negativem Erstabstrich und anderen Krankheitszeichen der Lunge in der Bildgebung soll von einer COVID-19 ausgegangen werden. Der Abstrich ist binnen drei Tagen zu wiederholen oder eine Lungenspiegelung durchzuführen. Die Empfehlung legt großen Wert auf den Eigenschutz des Personals, das mit Gummistiefeln, Augenschutz sowie flüssigkeitsbeständiger Atemmaske augestattet werden soll. Das Schema geht von einer Beatmungsdauer von im Mittel rund 25 Tagen bei schweren Fällen aus.[88]
Bei den Patienten, welche aufgrund der Viruspneumonie ein akutes Lungenversagen entwickeln, gelten die üblichen Prinzipien der Beatmungstherapie bei Viruspneumonie. Dabei sollte möglichst früh eine Intubation angestrebt werden, um eine lungenprotektive, maschinelle Beatmung zu ermöglichen. Eine Überwässerung der Patienten ist unbedingt wegen der Gefahr des zusätzlichen Lungenödems zu vermeiden. Eine non-invasive Beatmung über hochvolumigen Sauerstoff birgt die Gefahr einer Aerosolierung des Virus und damit eine erhöhte Ansteckungsgefahr für das am Patienten arbeitende Personal.[89]
Die WHO riet zeitweise von der Einnahme von Ibuprofen ab und empfahl stattdessen Paracetamol. Der französische nationale Gesundheitsdirektor Jérôme Salomon riet zudem von der Einnahme nichtsteroidaler Antirheumatika (NSAR) allgemein ab. Dazu zählen auch Acetylsalicylsäure und Diclofenac.[90] Ibuprofen sowie Glitazone steigern das Vorhandensein des ACE2-Rezeptors, der als Angriffspunkt des Virus dient.[91] Nur kurz später nahm die WHO ihre Warnung vor der Einnahme von Ibuprofen bei Verdacht auf eine Corona-Infektion zurück.[92]
In Wuhan wurden einige Patienten mit Hydroxychloroquin behandelt. Es hat denselben Wirkmeachnismus wie Chloroquin, soll aber besser verträglich sein. Bei der Anwendung soll ein immunmodulatorischer Effekt eingetreten sein, der sich positiv auf die Dämpfung des Zytokinsturms ausgewirkt haben soll. Die Autoren weisen ausdrücklich darauf hin, dass es derzeit keine ausreichenden Belege für die Wirksamkeit von Hydroxychloroquin bei SARS-CoV-2-Infektionen gibt.[93] Ein solcher Wirksamkeitsnachweis kann nur durch eine Phase-III-Studie erfolgen. Andere Autoren kommen in einem Übersichtsartikel zu dem Ergebnis, dass ausreichend Gründe (präklinische Daten zur Wirksamkeit und langjährige Daten zum klinischen Sicherheitsprofil) gibt, die die Anwendung von Hydroxychloroquin bei COVID-19-Patienten rechtfertigen. Die klinische Anwendung sollte jedoch entweder den Vorgaben der Weltgesundheitsorganisation (WHO) für den „Nothilfe-Einsatz noch nicht registrierter Medikamente“ (Monitored Emergency Use of Unregistered and Investigational Interventions, MEURI) entsprechen oder gemäß den Angaben der WHO als klinische Studie ethisch anerkannt sein. Sicherheits- und Wirksamkeitsdaten aus hochwertigen klinischen Studien würden dringend benötigt werden.[94] Hydroxychloroquin ist zur Therapie und Prophylaxe der Malaria tropica, sowie zur Behandlung der rheumatoiden Arthritis und Bindegewebserkrankungen wie dem systemischem Lupus erythematodes zugelassen.
Der gegen den Interleukin-6 gerichtete monoklonale Antikörper Tocilizumab wurde in China in einer kleineren Studie an COVID-19-Patienten getestet. Die Ergebnisse waren so vielversprechend, dass Tocilizumab in die Behandlungsleitlinien von Chinas Nationaler Gesundheitskommission aufgenommen wurden.[95] In Italien wird Tocilizumab derzeit in einer nicht-randomisierten Phase-II-Studie an COVID-19-Patienten getestet.[96][97][98] Tocilizumab ist unter anderem zur Behandlung verschiedener Formen von rheumatoider Arthritis und dem Zytokin-Freisetzungssyndrom[99] zugelassen.
Heilungsaussicht
| Sterblichkeitsrate bei Infizierten in | |||
|---|---|---|---|
| Alter | Skriptfehler: Ein solches Modul „Flagge“ ist nicht vorhanden.[100] | Skriptfehler: Ein solches Modul „Flagge“ ist nicht vorhanden.[101] | Skriptfehler: Ein solches Modul „Flagge“ ist nicht vorhanden.[102] |
| 0–9 Jahre | 0,0 % | 0,0 % | 0,0 % |
| 10–19 Jahre | 0,2 % | 0,0 % | 0,0 % |
| 20–29 Jahre | 0,2 % | 0,0 % | 0,0 % |
| 30–39 Jahre | 0,2 % | 0,0 % | 0,1 % |
| 40–49 Jahre | 0,4 % | 0,1 % | 0,1 % |
| 50–59 Jahre | 1,3 % | 0,2 % | 0,4 % |
| 60–69 Jahre | 3,6 % | 2,5 % | 1,4 % |
| 70–79 Jahre | 8,0 % | 6,4 % | 5,3 % |
| über 80 Jahre | 14,8 % | 13,2 % | 9,3 % |
Die WHO gab mit ihrem Situation Report – 18 vom 7. Februar 2020 beispielsweise für China bei 31.211 bestätigt infizierten Personen 4.821 Patienten (15,4 %) mit schweren Krankheitsverläufen bekannt.[103] Genaue Angaben zur Sterblichkeit sind im Moment jedoch nicht möglich. Aufgrund bisher noch unbekannter weniger symptomatischer Fälle kann die Letalität einerseits geringer ausfallen. Auf der anderen Seite können die Patienten, die noch nicht genesen sind, noch versterben und damit kann die Letalität höher ausfallen. Auch für den Anteil der schweren Verläufe gilt dies. Bei Diagnosestellung muss noch nicht bekannt sein, ob der Patient schwer erkrankt oder sogar stirbt. Im Folgenden werden einige Studien zitiert, die Hinweise auf die Letalität geben.
Bei einer epidemiologischen Betrachtung von 99 hospitalisierten Fällen waren bis zum 25. Januar 2020 11 % gestorben, 31 % entlassen und 58 % noch im Krankenhaus.[104]
In einer am 2. Februar 2020 vorab veröffentlichten Studie wurde die Letalität der bestätigten Fälle geschätzt. Hierbei wurde sowohl die Zeit zwischen dem Einsetzen der ersten Krankheitszeichen und der Diagnosestellung (5,1 Tage, 95 % KI: 3,5–7,5) als auch die Zeit zwischen dem Einsetzen der ersten Krankheitszeichen und dem Tod (15,2 Tage, 95 % KI: 13,1–17,7) berücksichtigt. Im 1. Szenario wurde die Epidemie auf der Grundlage des Indexpatienten vom 8. Dezember 2019 kalkuliert und eine Letalität von 4,6 % (95 % KI: 3,1–6,6) berechnet. Im 2. Szenario wurde anhand der in andere Länder exportierten Fälle eine Epidemie simuliert und eine Letalität von 7,7 % (95 % KI: 4,9–11,3) ermittelt. Die Autoren weisen darauf hin, dass die tatsächliche Letalität durch nicht diagnostizierte Fälle entsprechend niedriger ausfallen könnte.[105] In einer Schätzung aufgrund von WHO-Daten vom 12. März 2020 kamen die Studienautoren zu dem Schluss, dass, je nach medizinischer Versorgungssituation, eine Sterblichkeit von bis zu 20 % möglich sei. Aus der Analyse der bis zum Studienendpunkt vorliegenden WHO-Daten schätzten die Autoren die Sterblichkeit auf rund 6 % innerhalb Chinas und rund 15 % außerhalb Chinas. Die Autoren weisen darauf hin, dass die aktuell vorliegenden Fallzahlen zu einer Unterschätzung der Sterblichkeit führen könnten.[106] Hingegen kam eine am 19. März 2020 veröffentlichte Studie chinesischer und amerikanischer Forscher unter Verwendung der Fallzahlen vom 29. Februar 2020 in Wuhan zu der Schätzung, dass die Letalität dort lediglich 1,4 % betragen habe (95 % KI: 0,9–2,1 %). Die Autoren betonen jedoch, dass sich Annahmen und Daten des Modells unmittelbar auf Wuhan beziehen, weshalb eine Generalisierung auf die Situation in anderen Ländern nicht möglich ist.[107]
In einem Tierexperiment an Rhesusaffen konnte eine chinesische Forschergruppe in einer vorläufigen Studie zeigen, dass die Tiere nach einer durchgemachten COVID-19-Pneumonie und erneuter Virusexposition keine messbare Virus-RNA im Rachen aufwiesen oder über den Verdauungstrakt ausschieden. Die Forschergruppe geht aufgrund der Daten davon aus, dass bei durchgemachter COVID-19 keine akute Reinfektion möglich ist.[108][109]
Vorbeugung
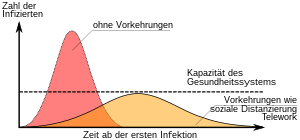
Entwicklung von Impfstoffen
Bereits unmittelbar nach Veröffentlichung der RNA-Sequenz des Virus wurde in mehreren Laboren mit der Impfstoffentwicklung begonnen.[71] Die internationale Impfstoffinitiative CEPI (Coalition for Epidemic Preparedness Innovations) plante, bis Mitte Juni 2020 erste Tests mit bis dahin entwickelten Impfstoffen durchzuführen. Dafür erhielten mehrere potentiell geeignete Unternehmen finanzielle Unterstützungen.[27] In Deutschland betraf dies u. a. die Tübinger Biotechnologiefirma Curevac, die zusammen mit dem Paul-Ehrlich-Institut an der schnellen Impfstoffentwicklung arbeitete.[110][111] Das Robert Koch-Institut verwies darauf, dass derzeit klinische Studien mit Impfstoffen gegen MERS-CoV laufen würden.[14] Allerdings sind klinische Studien lediglich der erste Schritt, es würde bei erfolgreichem Studienverlauf voraussichtlich frühestens in mehreren Monaten ein Impfstoff zur Verfügung stehen, der allerdings in einer ersten Phase sicher nicht für die gesamte Bevölkerung bereitgestellt werden könnte.[112]
Impfung gegen andere Infektionen
Die Berliner Senatsgesundheitsverwaltung empfahl Ende Februar 2020 allen Menschen über 60 Jahre und chronisch Kranken, ihren Impfstatus zu überprüfen und gegebenenfalls die Impfung gegen Pneumokokken (Impfstoffe wie Pneumovax 23 waren jedoch im März 2020 nur noch eingeschränkt lieferbar[113]) und Keuchhusten (Pertussis) durchführen oder auffrischen zu lassen. Da Menschen über 60 Jahre und chronisch Kranke durch SARS-CoV besonders gefährdet sind, seien sie vorsorglich zu schützen.[114][115]
Hygienemaßnahmen
Allgemeinbevölkerung
Das Robert Koch-Institut hat am 28. Januar 2020 Hinweise für die Allgemeinbevölkerung gegeben, wie man das Risiko für eine Ansteckung wesentlich verringern kann. Hierbei wird in erster Linie auf folgende Punkte hingewiesen:
- auf eine gute Händehygiene achten (u. a. Hände mit Seife waschen: vor dem Essen, nach Kontakt zu anderen Menschen, nach dem Toilettengang, nach Niesen/Husten)
- einen Mindestabstand von ca. 1 Meter zu krankheitsverdächtigen Personen halten
- korrekte Hustenetikette (möglichst in die Armbeuge husten oder niesen, nicht in die Hand)
Die Weltgesundheitsorganisation (WHO) empfiehlt folgendes:[116]
- regelmäßig und gründlich die Hände mit Wasser und Seife waschen oder mit einem Handdesinfektionsmittel auf Alkoholbasis desinfizieren
- möglichst nicht Augen, Nase oder Mund berühren
- Das Bundesministerium für Gesundheit empfiehlt, beim Sprechen zur anderen Person 1,5 bis 2 Meter Abstand zu halten.[117]
- Die Bundeszentrale für gesundheitliche Aufklärung empfiehlt, sich beim Husten, Niesen oder Naseputzen von anderen Menschen abzuwenden und in die Armbeuge zu niesen oder zu husten bzw. in ein Taschentuch, das danach sofort entsorgt werden muss, und sich nach jedem Husten, Niesen oder Naseputzen gründlich die Hände zu waschen.[118]
- zuhause bleiben, wenn man sich krank fühlt – außer zu einem vorher telefonisch vereinbarten Arztbesuch
- bei Fieber, Husten und Kurzatmigkeit keinesfalls gleich einen Arzt aufsuchen, sondern beim Arzt oder beim Gesundheitsamt anrufen.[119]
- auch bei milden Symptomen, wie z. B. leicht laufender Nase oder Kopfschmerzen, zuhause bleiben.
Atemschutzmasken werden in erster Linie für Kranke selbst und für Personen empfohlen, die engen Kontakt mit Erkrankten haben. Ob das Tragen eines Mund-Nasen-Schutzes in der Öffentlichkeit das Risiko, sich selbst anzustecken, wesentlich reduziert, sei laut dem RKI nicht wissenschaftlich belegt.[14] Seit 2008 liegt eine experimentelle Studie vor, welche zu dem Schluss kommt dass jede Art von Mund-Naseschutz, auch bei ungenügendem Sitz oder bei improvisiertem Material die Virusexposition vermindert. Die Autoren schliessen daraus dass das generelle Tragen von Masken durch die Bevölkerung die Übertragung von Atemwegserkrankungen vermindern könne.[120]
In Ostasien gilt die Verwendung von Masken für die Allgemeinbevölkerung als zentrales Element der Prävention. Im März 2020 empfahlen Mediziner aus Hong Kong anderen Ländern, diese Praxis ebenso einzuführen.[121] Die Tschechische Republik entschied sich im März 2020, das Tragen von Masken im öffentlichen Raum verpflichtend einzuführen.[122]
Medizinisches Personal
Das Robert Koch-Institut hat am 24. Januar 2020 erste Hinweise gegeben, welche Hygienemaßnahmen zur Vermeidung einer Übertragung des Erregers durch Tröpfchen auf medizinisches Personal notwendig sind. Die empfohlenen Schutzmaßnahmen bestehen insbesondere aus dem Tragen eines langärmeligen Schutzkittels, einer Schutzbrille, einer Atemschutzmaske mindestens vom Standard FFP2 und von Schutzhandschuhen. Zur chemischen Desinfektion der Hände und Flächen sind Desinfektionsmittel geeignet, die die Wirkungsbereiche „begrenzt viruzid“, „begrenzt viruzid PLUS“ oder „viruzid“ abdecken.[123][124] Eine Auswertung von 22 Studien, die sich mit der Persistenz und Inaktivierung von medizinisch relevanten Coronaviren (wie SARS-CoV und MERS-CoV) unter anderem in Gesundheitseinrichtungen beschäftigen, zeigt, dass für die Oberflächendesinfektion Mittel auf der Basis von Ethanol, Wasserstoffperoxid oder Natriumhypochlorit in entsprechender Konzentration wirksam sind.[24] Neben der konsequenten Einhaltung der Basishygiene zählen außerdem die Unterbringung in einem Isolierzimmer möglichst mit Schleuse bzw. in einem Einzelzimmer mit eigener Nasszelle und das Abstellen eventuell vorhandener raumlufttechnischer Anlagen, über die ein Luftaustausch mit anderen Räumen möglich ist, zu den empfohlenen Hygienemaßnahmen.[125]
Zahnärztliche Behandlung
Bei einer zahnärztlichen Behandlung kommen meist Bohrinstrumente mit Wasserkühlung zum Einsatz. Dabei bildet sich Aerosol, was eine mögliche Übertragung erheblich begünstigt; dadurch ist das anwesende Behandlungsteam (Zahnarzt, Zahnmedizinische Assistenten/-innen) einem besonders hohen Ansteckungsrisiko ausgesetzt. Das erzeugt auch ein erhöhtes Infektionsrisiko für nachfolgende Patienten. Die notwendige Schutzausrüstung (Schutzbrille mit Seitenschutz oder Visier, Atemschutzmaske FFP2, sterile Handschuhe, langärmliger Schutzkittel, Kopfhaube) ist in vielen Zahnarztpraxen – auch wegen Lieferschwierigkeiten – nicht oder nur eingeschränkt vorhanden. Auch eine Einhaltung des empfohlenen Abstands ist aus praktischen Gründen nicht möglich. Zunehmend schließen Zahnarztpraxen. Zahnärzte sollten deshalb nur bei Notfällen (akute Zahnschmerzen, Zahnfraktur und ähnliches) aufgesucht werden. Regional unterschiedlich werden Zahnarztpraxen zum Notdienst eingeteilt, der sonst nur an Wochenenden und Feiertagen zur Verfügung steht. Routineuntersuchungen, Zahnreinigungstermine oder aufschiebbare Behandlungen (beispielsweise Anfertigung von Zahnersatz, Parodontitisbehandlungen) sollten bis auf Weiteres ganz entfallen. Patienten mit erhöhtem Risiko (hohes Alter, Lungenerkrankungen, Diabetiker, Krebspatienten, immunsupprimierte Patienten und Ähnliches) sind besonders gefährdet.[126]
Meldepflicht und ICD-10-Einordnung
In Deutschland ist laut Infektionsschutzgesetz (IfSG) das Auftreten einer bedrohlichen übertragbaren Erkrankung an das zuständige Gesundheitsamt zu melden (§ 6 Abs. 1 Nr. 5 IfSG). Mit Wirkung vom 1. Februar 2020 wurde durch die Coronavirus-Meldepflichtverordnung eine Ausdehnung der Meldepflicht beschlossen. Nach dieser Verordnung sind sowohl der Verdacht einer Erkrankung, die Erkrankung und der Tod als auch der laborchemische Nachweis einer akuten Infektion mit dem neuartigen Coronavirus meldepflichtig. Die Meldung des Verdachts hat nur zu erfolgen, wenn der Verdacht sowohl durch das klinische Bild als auch durch einen wahrscheinlichen epidemiologischen Zusammenhang begründet ist. Dabei ist die Empfehlung[127] zu berücksichtigen, die das Robert Koch-Institut veröffentlicht. Ausnahmsweise muss man bei diesem Virus auch melden, wenn sich der Verdacht nicht bestätigt. Diese Verordnung gilt bis zum 1. Februar 2021,[veraltet] sofern nicht mit Zustimmung des Bundesrates etwas anderes verordnet wird.
In Österreich besteht ebenfalls Anzeigepflicht und zwar nach dem Epidemiegesetz[128] von 1950 zusammen mit einer Verordnung.[129] Die Pflicht zur Anzeige besteht für Verdachts-, Erkrankungs- und Todesfälle aufgrund dieses Virus. Zudem wurde auch die Absonderungsverordnung[130] um das neue Coronavirus erweitert.[131]
Auch in der Schweiz existiert eine Meldepflicht.[132] Diese folgt aus dem Epidemiengesetz[133] der Schweiz in Verbindung mit der Epidemienverordnung[134] und der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen[135] Nach Anhang 1 der Verordnung des EDI müssen Ärzte einen klinischen Verdacht und die Veranlassung einer erregerspezifischen Labordiagnostik und den nötigen epidemiologischen Zusammenhang melden. Nach Anhang 3 der Verordnung des EDI müssen Labore einen positiven und negativen Befund (also Nachweis) melden. Das Bundesamt für Gesundheit hat hierzu Verdachts-, Beprobungs-, Meldekriterien veröffentlicht.[136]
Am 17. Februar 2020 wurde die Krankheit durch die WHO in die Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme in der aktuellen, international gültigen Ausgabe ICD-10-WHO aufgenommen (Schlüsselnummer U07.1). Auch für die in Deutschland geltende ICD-10-GM (German Modification) wurde ein sekundärer Kode (Ausrufezeichenschlüsselnummer) vergeben (U07.1!) und die Krankheit als COVID-19 Coronavirus-Krankheit-2019 bezeichnet.[137] Weiterhin erfolgte eine entsprechende Ergänzung für die Todesursachenkodierung in der ICD-10-GM.[14]
COVID-19 und Haustiere
Während innerhalb der Corona-Virusfamilie Coronaviridae einzelne Viren, wie das CCoV und das FCoV, auch bei Haustieren Erkrankungen auslösen,[138] ist bislang kein Fall bekannt, in dem ein Haustier an SARS-CoV-2 erkrankte.[139][140][141] Obwohl bei einem Hund das Virus in Abstrichen aus Nase und Schnauze nachgewiesen werden konnte,[142] löste es bei ihm keine Erkrankung aus.[141] Es gibt laut WHO keine Hinweise, dass Haustiere das Virus als Träger weiterverbreiten.[139][141]
Siehe auch
Weblinks
- Johns Hopkins CSSE: Coronavirus 2019-nCoV Global Cases. Aktuelle Zahlen für bestätigte Infektionen, Todesfälle und Genesungen nach Ländern und Regionen – laufend aktualisiert. In: Website des Johns Hopkins University Center for Systems Science and Engineering. 8. Februar 2020, abgerufen am 8. Februar 2020 (english, zum Daten-Update Seite jeweils neu laden).
- COVID-19 (Coronavirus SARS-CoV-2). Übersichtsseite des Robert Koch-Instituts (RKI). In: Website des Robert Koch-Instituts. 13. März 2020, abgerufen am 13. März 2020.
- SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19). In: Website des Robert Koch-Instituts. 10. März 2020, abgerufen am 13. März 2020.
- Antworten auf häufig gestellte Fragen zum Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 13. März 2020, abgerufen am 13. März 2020.
- Atemwegserkrankungen durch neuartiges Coronavirus (2019-nCoV): Virusübertragung durch den Verzehr von Lebensmitteln oder den Kontakt mit Bedarfsgegenständen ist unwahrscheinlich. (PDF; 56 kB) In: Mitteilung des Bundesinstituts für Risikobewertung (BfR). 29. Januar 2020, abgerufen am 8. Februar 2020.
- Kann das neuartige Coronavirus über Lebensmittel und Spielzeug übertragen werden? Fragen und Antworten des BfR. In: Website des Bundesinstituts für Risikobewertung (BfR). 3. Februar 2020, abgerufen am 8. Februar 2020.
- Coronavirus – Fragen und Antworten. In: bmel.de. Bundesministerium für Ernährung und Landwirtschaft (BMEL), 12. März 2020, abgerufen am 17. März 2020.
- Aktuelle Informationen zum Coronavirus. In: Website des Bundesministerium für Gesundheit. 7. Februar 2020, abgerufen am 8. Februar 2020.
- COVID-19. In: Website des Europäischen Zentrums für die Prävention und die Kontrolle von Krankheiten (ECDC). 17. März 2020, abgerufen am 17. März 2020 (english).
- Weltgesundheitsorganisation: Novel coronavirus (2019-nCoV). In: Website der Weltgesundheitsorganisation (WHO). (english).
- Wie gefährlich ist das neue Coronavirus aus China? Wissenschaftlich geprüft von Jasmina Neudecker. In: YouTube-Kanal von Terra X Lesch & Co. 30. Januar 2020, abgerufen am 8. Februar 2020.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19). Robert Koch-Institut, 13. März 2020, abgerufen am 21. März 2020.
- ↑ Elizabeth Cheung: Coronavirus: some recovered patients may have reduced lung function and are left gasping for air while walking briskly, Hong Kong doctors find. In: South China Morning Post. South China Morning Post Publishers, 13. März 2020, archiviert vom Original am 12. März 2020; abgerufen am 19. März 2020.
- ↑ Karl Lauterbach zu Corona „Die Bevölkerung schätzt die Lage falsch ein“. In: Website. 18. März 2020, abgerufen am 19. März 2020.
- ↑ 4,0 4,1 4,2 Zunyou Wu, Jennifer M. McGoogan, CCDC: Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. In: Journal of the American Medical Association. 2020-02-24 doi:10.1001/jama.2020.2648.
- ↑ Ulf Poschardt: Augenmaß und Zuversicht. Deutschland lernt in der Krise. In: Welt Online. 12. März 2020, abgerufen am 13. März 2020.
- ↑ Timothy W. Russell, et. al.: Estimating the infection and case fatality ratio for COVID-19 using age-adjusted data from the outbreak on the Diamond Princess cruise ship. 12. März 2020, abgerufen am 20. März 2020.
- ↑ D. Baud, X. Qi, K. Nielsen-Saines, D. Musso, L. Pomar, G. Favre: Real estimates of mortality following COVID-19 infection. In: The Lancet. 12. März 2020, abgerufen am 20. März 2020.
- ↑ 8,0 8,1 Tedros Adhanom Ghebreyesus: WHO Director-General’s opening remarks at the media briefing on COVID-19 – 24 February 2020. In: Website Weltgesundheitsorganisation (WHO). 24. Februar 2020, abgerufen am 26. Februar 2020 (english).
- ↑ Na Zhu, Dingyu Zhang, Wenling Wang et al.: A Novel Coronavirus from Patients with Pneumonia in China. 2019. In: The New England Journal of Medicine. 24. Januar 2020, doi:10.1056/NEJMoa2001017 (englisch)
- ↑ Nicky Phillips, Smriti Mallapaty, David Cyranoski: How quickly does the Wuhan virus spread?. In: Nature. 2020-01-21 doi:10.1038/d41586-020-00146-w.
- ↑ 11,0 11,1 Zhangkai J. Cheng, Jing Shan: 2019 Novel coronavirus: where we are and what we know. In: Infection. 2020-02-18 doi:10.1007/s15010-020-01401-y.
- ↑ 12,0 12,1 12,2 How COVID-19 Spreads. In: Website der US-amerikanischen Centers for Disease Control and Prevention (CDC). 17. Februar 2020, abgerufen am 23. Februar 2020 (english).
- ↑ Beschluss 1/2020 des ABAS vom 19. Februar 2020 und Begründung zur vorläufigen Einstufung des Virus SARS-CoV-2 in Risikogruppe 3 und Empfehlungen zu nicht gezielten Tätigkeiten (Labordiagnostik) und gezielten Tätigkeiten mit SARS-CoV-2. (PDF; 140 kB) In: Website der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin. 19. Februar 2020, abgerufen am 23. Februar 2020.
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 14,6 Antworten auf häufig gestellte Fragen zum Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 13. März 2020, abgerufen am 13. März 2020.
- ↑ van Doremalen N, Bushmaker T, Morris DH, Holbrook MG, Gamble A, Williamson BN, Tamin A, Harcourt JL, Thornburg NJ, Gerber SI, Lloyd-Smith JO, de Wit E, Munster VJ: Aerosol- und Oberflächenstabilität von SARS-CoV-2 im Vergleich zu SARS-CoV-1. In: The New England Journal of Medicine. 2020-03-17 doi:10.1056/nejmc2004973.
- ↑ Gene Emery: Coronavirus kann stundenlang in der Luft und tagelang auf Oberflächen bestehen. In: Website Reuters. 17. März 2020, abgerufen am 21. März 2020 (english).
- ↑ 17,0 17,1 Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. In: The Lancet. 2020-01-24 doi:10.1016/S0140-6736(20)30154-9.
- ↑ Michelle L. Holshue, Chas DeBolt et al. for the Washington State 2019-nCoV Case Investigation Team: First Case of 2019 Novel Coronavirus in the United States. In: The New England Journal of Medicine. 2020-01-31 doi:10.1056/NEJMoa2001191.
- ↑ 19,0 19,1 19,2 Lirong Zou, Feng Ruan, Mingxing Huang et al.: SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. In: The New England Journal of Medicine. 2020-02-19 doi:10.1056/NEJMc2001737.
- ↑ Informationen der BAuA: Neuartiges Virus SARS-CoV-2 (bislang 2019-nCoV) durch den ABAS in Risikogruppe 3 eingestuft und Empfehlungen zur Labordiagnostik gegeben. In: Website der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 19. Februar 2020, abgerufen am 23. Februar 2020.
- ↑ Emmie de Wit, Vincent J. Munster et al. : Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. NEJM, 17. März 2020, doi:10.1056/NEJMc2004973
- ↑ Yunyun Zhou, Yuyang Zeng, Yongqing Tong, Changzheng Chen: Ophthalmologic evidence against the interpersonal transmission of 2019 novel coronavirus through conjunctiva. In: Medrxiv. 2020-02-12 doi:10.1101/2020.02.11.20021956.
- ↑ Wei Deng, Linlin Bao, Hong Gao et al.: Rhesus macaques can be effectively infected with SARS-CoV-2 via ocular conjunctival route. In: Biorxiv. 2020-03-14 doi:10.1101/2020.03.13.990036.
- ↑ 24,0 24,1 Günter Kampf, Daniel Todt, Stephanie Pfaender, Eike Steinmann: Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. In: The Journal of Hospital Infection. 2020-02-06 doi:10.1016/j.jhin.2020.01.022.
- ↑ Meike Drießen: Wie lang Coronaviren auf Flächen überleben und wie man sie inaktiviert. In: Website Informationsdienst Wissenschaft (idw). 7. Februar 2020, abgerufen am 8. Februar 2020.
- ↑ 26,0 26,1 2019-nCoV offenbar schon bei sehr leichten Symptomen übertragbar. In: Website Deutsches Ärzteblatt. 4. Februar 2020, abgerufen am 5. Februar 2020.
- ↑ 27,0 27,1 27,2 Lars Fischer, Alina Schadwinkel: Verursacht das Coronavirus Engpässe bei Medikamenten? Stammt das Virus aus dem Pangolin? Website Spektrum.de, 10. Februar 2020, abgerufen am 15. Februar 2020.
- ↑ Ian Sample: Coronavirus: many infections spread by people yet to show symptoms – scientists. In: The Guardian. 2020-03-12 ISSN 0261-3077 (https://www.theguardian.com/science/2020/mar/12/coronavirus-most-infections-spread-by-people-yet-to-show-symptoms-scientists).
- ↑ Severe Outcomes Among Patients with Coronavirus Disease 2019 (COVID-19) — United States, February 12–March 16, 2020. In: Morbidity and Mortality Weekly Report. 69, Centers for Disease Control and Prevention, 2020-03-18, doi:10.15585/mmwr.mm6912e2.
- ↑ Xiaoxia Lu, Liqiong Zhang, Hui Du et al. : SARS-CoV-2 Infection in Children. NEJM, 18. März 2020, doi:10.1056/NEJMc2005073
- ↑ 31,0 31,1 Yan Bai, Lingsheng Yao, Tao Wei et al.: Presumed Asymptomatic Carrier Transmission of COVID-19. In: Journal of the American Medical Association. 2020-02-21 doi:10.1001/jama.2020.2565.
- ↑ Q. Li, X. Guan, P. Wu et al.: Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia. In: The New England Journal of Medicine. 2020-01-29 doi:10.1056/NEJMoa2001316.
- ↑ Coronavirus disease 2019 (COVID-19). (PDF; 1,1 MB) Situation Report – 30. Weltgesundheitsorganisation (WHO), 19. Februar 2020, abgerufen am 23. Februar 2020.
- ↑ Camilla Rothe, Mirjam Schunk, Peter Sothmann et al.: Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany. In: The New England Journal of Medicine. 2020-01-30 doi:10.1056/NEJMc2001468.
- ↑ Kai Kupferschmidt: Study claiming new coronavirus can be transmitted by people without symptoms was flawed. In: Science. 2020-02-03 (https://www.sciencemag.org/news/2020/02/paper-non-symptomatic-patient-transmitting-coronavirus-wrong).
- ↑ Sandra Ciesek et al.: Evidence of SARS-CoV-2 Infection in Returning Travelers from Wuhan, China. NEJM, 18. Februar 2018 doi:10.1056/NEJMc2001899
- ↑ Jing Liu: Asymptomatic cases in a family cluster with SARS-CoV-2 infection. Lancet, 19. Februar 2020, doi:10.1016/S1473-3099(20)30114-6
- ↑ Zhou F et al. : Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet, 9. März 2020 doi:10.1016/S0140-6736(20)30566-3
- ↑ Haibo Xu et al.: Positive RT-PCR Test Results in Patients Recovered From COVID-19. JAMA, 27. Februar 2020, doi:10.1001/jama.2020.2783
- ↑ Einzelne genesene COVID-19-Patienten positiv auf SARS-CoV-2 getestet. In: Website Sciencemediacentre Germany. 2. März 2020, abgerufen am 4. März 2020.
- ↑ 41,0 41,1 Peng Zhou, Xing-Lou Yang, Xian-Guang Wang et al.: A pneumonia outbreak associated with a new coronavirus of probable bat origin. In: Nature. 2020-02-03 doi:10.1038/s41586-020-2012-7 (dieser Artikel wurde am 23. Januar 2020 vorab ohne Peer-Review auf bioRxiv veröffentlicht).
- ↑ Sean Wei Xiang Ong, Yian Kim Tan, Po Ying Chia et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, 4. März 2020 doi:10.1001/jama.2020.3227
- ↑ 43,0 43,1 Yu Zhao, Zixian Zhao, Yujia Wang, Yueqing Zhou, Yu Ma, Wei Zuo: Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. In: BioRxiv. 2020-01-26 doi:10.1101/2020.01.26.919985.
- ↑ 44,0 44,1 Haibo Zhang, Josef M. Penninger, Yimin Li, Nanshan Zhong & Arthur S. Slutsky: Angiotensin‑converting enzyme 2 (ACE2) as a SARS‑CoV‑2 receptor: molecular mechanisms and potential therapeutic target. In: Intensive Care Medicine. 2020-03-03 doi:10.1007/s00134-020-05985-9.
- ↑ Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). (PDF; 1,6 MB) 16–24 February 2020. Weltgesundheitsorganisation (WHO), 28. Februar 2020, abgerufen am 2. März 2020.
- ↑ 46,0 46,1 Antworten auf häufig gestellte Fragen zum Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 25. Februar 2020, abgerufen am 26. Februar 2020.
- ↑ Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. In: The Lancet. 2020-01-24 doi:10.1016/S0140-6736(20)30154-9.
- ↑ 48,0 48,1 C. Huang, Y. Wang, X. Li et al.: Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. In: The Lancet. 2020-01-24 doi:10.1016/S0140-6736(20)30183-5.
- ↑ Peter-Philipp Schmitt: Virologe Hendrik Streeck: „Wir haben neue Symptome entdeckt“. In: FAZ.NET. ISSN 0174-4909 (https://www.faz.net/1.6681450).
- ↑ Nanshan Chen, Min Zhou, Xuan Dong et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. In: The Lancet. 2020-01-30 doi:10.1016/S0140-6736(20)30211-7.
- ↑ 2019-nCoV: Erste Bilder vom Virus und Erkenntnisse zum klinischen Verlauf. In: Website Deutsches Ärzteblatt. 27. Januar 2020, abgerufen am 11. Februar 2020.
- ↑ J. F. Bermejo-Martin, R. Almansa u. a.: Lymphopenic community acquired pneumonia as signature of severe COVID-19 infection. In: The Journal of Infection. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/j.jinf.2020.02.029, PMID 32145214.
- ↑ Katarina Zimmer: Why Some COVID-19 Cases Are Worse than Others. In: the-scientist.com. 24. Februar 2020, abgerufen am 22. März 2020 (english).
- ↑ P. Mehta, D. F. McAuley u. a.: COVID-19: consider cytokine storm syndromes and immunosuppression. In: The Lancet. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/S0140-6736(20)30628-0, PMID 32192578.
- ↑ Sven Siebenand: Diagnosestellung: Lymphopenie als Marker für schweren Verlauf von Covid-19. In: pharmazeutische-zeitung.de. 16. März 2020, abgerufen am 22. März 2020.
- ↑ 56,0 56,1 Tedros Adhanom Ghebreyesus: WHO Director-General’s opening remarks at the media briefing on COVID-19 – 24 February 2020. In: Website Weltgesundheitsorganisation (WHO). 24. Februar 2020, abgerufen am 26. Februar 2020 (english).
- ↑ Wenling Wang, Yanli Xu, Ruqin Gao: Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA, 11. März 2020, doi:10.1001/jama.2020.3786
- ↑ 58,0 58,1 Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases. In: Website WHO. Weltgesundheitsorganisation (WHO), 17. Januar 2020, abgerufen am 5. Februar 2020 (english).
- ↑ CDC Tests for 2019-nCoV. In: Website der US-amerikanischen Centers for Disease Control and Prevention (CDC). 5. Februar 2020, abgerufen am 10. Februar 2020 (english).
- ↑ Fatima Amanat, Thi Nguyen, Veronika Chromikova et al.: A serological assay to detect SARS-CoV-2 seroconversion in humans. In: Medrxiv. 2020-03-18 doi:10.1101/2020.03.17.20037713.
- ↑ Jin Gu et al. : Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Inf Dis, doi:10.1016/S1473-3099(20)30086-4
- ↑ Huang, Yi and Wang, Sihan and Liu, Yue and Zhang, Yaohui and Zheng, Chuyun and Zheng, Yu and Zhang, Chaoyang and Min, Weili and Zhou, Huihui and Yu, Ming and Hu, Mingjun, A Preliminary Study on the Ultrasonic Manifestations of Peripulmonary Lesions of Non-Critical Novel Coronavirus Pneumonia (COVID-19) (February 26, 2020). doi
- ↑ Jaffar Al-Tawfiq, Ziad A. Memish : Diagnosis of SARS-CoV-2 Infection based on CT scan vs. RT-PCR: Reflecting on Experience from MERS-CoV. Journal of Hospital Infection, doi:10.1016/j.jhin.2020.03.001
- ↑ 64,0 64,1 Jinnong Zhang, Luqian Zhou, Yuqiong Yang et al.: Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. In: The Lancet Respiratory Medicine. 2020-02-13 doi:10.1016/S2213-2600(20)30071-0.
- ↑ Zhijian Xu, Cheng Peng, Yulong Shi et al.: Nelfinavir was predicted to be a potential inhibitor of 2019 nCov main protease by an integrative approach combining homology modelling, molecular docking and binding free energy calculation. In: bioRxiv. 2020-01-28 S. 2020.01.27.921627, doi:10.1101/2020.01.27.921627.
- ↑ Jon Cohen: Can an anti-HIV combination or other existing drugs outwit the new coronavirus?. In: Science. 2020-01-27 doi:10.1126/science.abb0659.
- ↑ Xin Liu, Xiu-Jie Wang: Potential inhibitors for 2019-nCoV coronavirus M protease from clinically approved medicines. In: bioRxiv. 2020-01-29 doi:10.1101/2020.01.29.924100.
- ↑ Catharine I. Paules, Hilary D. Marston, Anthony S. Fauci: Coronavirus Infections – More Than Just the Common Cold. In: Journal of the American Medical Association. 2020-01-23 doi:10.1001/jama.2020.0757, PMID 31971553.
- ↑ 上海药物所和上海科技大学联合发现一批可能对新型肺炎有治疗作用的老药和中药 (Chinese) Chinese Academy of Sciences. 25. Januar 2020.
- ↑ Fu-Sheng Wang, Chao Zhang: What to do next to control the 2019-nCoV epidemic?. In: The Lancet. Band 395, Nr. 10222, 2020-02-08 S. 391–393, doi:10.1016/S0140-6736(20)30300-7.
- ↑ 71,0 71,1 Jon Cohen: Scientists are moving at record speed to create new coronavirus vaccines—but they may come too late. In: Science. 2020-01-27 doi:10.1126/science.abb0612.
- ↑ Jiaan Xia et al. : A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19. NEJM, 18. März 2020 doi:10.1056/NEJMoa2001282
- ↑ D. Wang, B. Hu, C. Hu et al.: Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. In: Journal of the American Medical Association. 2020-02-07 doi:10.1001/jama.2020.1585.
- ↑ Wang Xiaoyu: Drugs with potential against coronavirus in human trials. In: Website China Daily. 15. Februar 2020, abgerufen am 16. Februar 2020 (english).
- ↑ Zhang Yangfei: First antiviral drug approved to fight coronavirus. In: Website China Daily. 17. Februar 2020, abgerufen am 17. Februar 2020 (english).
- ↑ Favipiravir shows good clinical efficacy in treating COVID-19: official, Xinhuanet, 17. März 2020, zuletzt abgerufen am 19. März 2020
- ↑ Manli Wang, Ruiyuan Cao, Leike Zhang, Xinglou Yang, Jia Liu, Mingyue Xu, Zhengli Shi, Zhihong Hu, Wu Zhong, Gengfu Xiao: Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Letter to the Editor. In: Cell Research. 30, 2020-02-04 doi:10.1038/s41422-020-0282-0.
- ↑ Jianjun Gao, Zhenxue Tian, Xu Yan: Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Letter. In: BioScience Trends. 14, Nr. 1, 2020-02-29 doi:10.5582/bst.2020.01047.
- ↑ Philippe Gautret, Jean-Christophe Lagier, Philippe Parola, Van Thuan Hoang, Line Meddeb, Morgane Mailhe, Barbara Doudier, Johan Courjon, Valérie Giordanengo, Vera Esteves Vieira, Hervé Tissot Dupont, Stéphane Honoré, Philippe Colson, Eric Chabrière, Bernard La Scola, Jean-Marc Rolain, Philippe Brouqui, Didier Raoult: Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. In: International Journal of Antimicrobial Agents. doi:10.1016/j.ijantimicag.2020.105949 (Im Erscheinen, Vorabveröffentlichung, https://www.mediterranee-infection.com/wp-content/uploads/2020/03/Hydroxychloroquine_final_DOI_IJAA.pdf).
- ↑ Tim Smith, Tony Prosser : COVID-19-Drug Therapy - Potential Options. Clinical Drug Information, Elsevier, 2020, abrufbar als PDF; zuletzt abgerufen am 20. März 2020
- ↑ INTERIM CLINICAL GUIDANCE FOR PATIENTS SUSPECTED OF/CONFIRMED WITH COVID-19 IN BELGIUM 19. März 2020, Version 4, zuletzt abgerufen am 20. März 2020
- ↑ http://www.lessentiel.lu: Luxemburg verfolgt das Thema Chloroquin genau, hier online, zuletzt eingesehen am 20. März 2020
- ↑ J. Gao et al.: Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies, BioScience Trends Advance Publication, DOI: 10.5582/bst.2020.01047, PDF, zuletzt eingesehen am 20. März 2020
- ↑ Wang Xiaodong: Plasma therapy could lead to development of vaccine for novel coronavirus pneumonia. In: Website China Daily. 17. Februar 2020, abgerufen am 18. Februar 2020 (english).
- ↑ Zhang Zhihao: More plasma needed from recovered coronavirus patients, experts say. In: Website China Daily. 17. Februar 2020, abgerufen am 18. Februar 2020 (english).
- ↑ China puts 245 COVID-19 patients on convalescent plasma therapy, Xinhuanet, 28. Februar 2020, zuletzt abgerufen am 18. März 2020
- ↑ Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder, Christian Drosten, Stefan Pöhlmann et al.: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. In: Cell. 2020-03-04 doi:10.1016/j.cell.2020.02.052.
- ↑ Therapieschema der italienischen Fachgesellschaft AdET (italienisch), abgerufen am 21. März 2020
- ↑ Robert E. Fowelr: Care for Criticall Ill Patients With COVID-19. JAMA, 11. März 2020 doi:10.1001/jama.2020.3633
- ↑ WHO rät von Einnahme von Ibuprofen bei Coronaverdacht ab. Die Welt, 17. März 2020.
- ↑ Lei Fang, George Karakiulakis, Michael Roth: Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?. In: The Lancet Respiratory Medicine. 2020-03-11 doi:10.1016/S2213-2600(20)30116-8.
- ↑ VIRUS/WHO-Rückzieher – keine Warnung vor Ibuprofen bei Covid-19-Verdacht. Focus Online, 19. März 2020.
- ↑ X. Yao, F. Ye u. a.: In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). In: Clinical Infectious Diseases. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1093/cid/ciaa237, PMID 32150618.
- ↑ A. Cortegiani, G. Ingoglia u. a.: A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19. In: Journal of critical care. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/j.jcrc.2020.03.005, PMID 32173110.
- ↑ Roxanne Liu, John Miller: China approves use of Roche drug in battle against coronavirus complications. In: reuters.com. 4. März 2020, abgerufen am 22. März 2020 (english).
- ↑ 3 patients get better on arthritis drug. In: ansa.it. 13. März 2020, abgerufen am 22. März 2020 (english).
- ↑ Coronavirus, via libera dell'Aifa al farmaco anti-artrite efficace su 3 pazienti e a un antivirale: test in 5 centri. In: ilmessaggero.it. 22. März 2020, abgerufen am 22. März 2020 (italiano).
- ↑ Randy Cron, W. Winn Chatham: How doctors can potentially significantly reduce the number of deaths from Covid-19. In: vox.com. 12. März 2020, abgerufen am 22. März 2020 (english).
- ↑ RoActemra - tocilizumab Committee for Medicinal Products for Human Use (CHMP), vom 28. Juni 2018
- ↑ Jörn Seidel: Coronavirus in NRW: Wer ist gefährdet und wer nicht? In: WDR. 5. März 2020, abgerufen am 14. März 2020. nach Daten der China CDC Weekly
- ↑ Cosa dice il nuovo rapporto dell’Istituto Superiore di Sanità sul coronavirus. In: Il Post. 11. März 2020, abgerufen am 14. März 2020 (italiano).
- ↑ The updates on COVID-19 in Korea as of 16 March. In: Press Release. Korea CDC, 16. März 2020, abgerufen am 16. März 2020.
- ↑ Novel Coronavirus (2019-nCoV). (PDF; 0,9 MB) Situation Report – 18. Weltgesundheitsorganisation (WHO), 7. Februar 2020, abgerufen am 8. Februar 2020.
- ↑ Nanshan Chen, Min Zhou, Xuan Dong et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. In: The Lancet. 2020-01-30 doi:10.1016/S0140-6736(20)30211-7.
- ↑ Sung-mok Jung, Andrei R. Akhmetzhanov, Katsuma Hayashi et al.: Real time estimation of the risk of death from novel coronavirus (2019-nCoV) infection: Inference using exported cases. In: medRxiv. 2020-02-02 doi:10.1101/2020.01.29.20019547.
- ↑ Guillaume Favre: Real estimates of mortality following COVID-19 infection. Lancet Inf Dis, doi:10.1016/S1473-3099(20)30195-X
- ↑ Joseph T. Wu, Kathy Leung, Mary Bushman, Nishant Kishore, Rene Niehus, Pablo M. de Salazar, Benjamin J. Cowling, Marc Lipsitch & Gabriel M. Leunget al.: Estimating clinical severity of COVID-19 from the transmission dynamics in Wuhan, China. In: Nature Medicine. 2020-03-19 doi:10.1038/s41591-020-0822-7.
- ↑ Chuan Qin et al.: Reinfection could not occur in SARS-CoV-2 infected rhesus macaques. In: bioRxiv. 2020-03-14 doi:10.1101/2020.03.13.990226 (https://web.archive.org/web/20200315144907/https://www.biorxiv.org/content/10.1101/2020.03.13.990226v1.full.pdf).
- ↑ Keine Mehrfachansteckung mit SARS-CoV-2 bei Affen. In: Ärzteblatt. Deutscher Ärzteverlag, 18. März 2020, archiviert vom Original am 19. März 2020; abgerufen am 19. März 2020.
- ↑ Sechste Infektion bestätigt: Kind in Bayern an Coronavirus erkrankt. In: Website tagesschau.de. 31. Januar 2020, abgerufen am 9. Februar 2020.
- ↑ Donald Trumps Test auf Coronavirus negativ ausgefallen. In: Der Spiegel – Politik. Abgerufen am 15. März 2020.
- ↑ Florian Schumann: Deutscher Coronavirus-Experte: „Wir müssen uns auf eine Pandemie einstellen“. In: Website Der Tagesspiegel. 13. Februar 2020, abgerufen am 15. Februar 2020.
- ↑ www.rki.de: Lieferengpässe.
- ↑ Gesundheitssenatorin begrüßt Ausweitung des Risikogebiets durch Robert-Koch-Institut. In: berlin.de. 26. Februar 2020, abgerufen am 29. Februar 2020.
- ↑ Coronavirus: Wann gilt der Katastrophenfall – und was folgt? In: rbb24.de. 26. Februar 2020, abgerufen am 29. Februar 2020.
- ↑ Coronavirus disease (COVID-19) advice for the public. Weltgesundheitsorganisation (WHO), 2020, archiviert vom Original am 15. März 2020; abgerufen am 15. März 2020 (englisch).
- ↑ Bundesministerium für Gesundheit: Basiswissen zum Coronavirus
- ↑ Hygiene beim Husten & Niesen. Bundeszentrale für gesundheitliche Aufklärung, archiviert vom Original am 13. März 2020; abgerufen am 15. März 2020.
- ↑ Bei Corona-Verdacht nicht zum Arzt: Wie Sie sich richtig verhalten
- ↑ Marianne van der Sande, Peter Teunis, Rob Sabel: Professional and Home-Made Face Masks Reduce Exposure to Respiratory Infections among the General Population. PLOS ONE, 9. Juli, doi:10.1371/journal.pone.0002618
- ↑ Chi Chiu Leung : Mass masking in the COVID-19 epidemic : people need guidance. Lancet, 3. März 2020, doi:10.1016/S0140-6736(20)30520-1
- ↑ Reisehinweise der deutschen Botschaft in Prag, Version vom 18 März 2020, zuletzt abgerufen am 19. März 2020
- ↑ Liste der vom Robert Koch-Institut geprüften und anerkannten Desinfektionsmittel und -verfahren. In: Website des Robert Koch-Instituts. 6. September 2018, abgerufen am 8. Februar 2020.
- ↑ Empfehlungen des Robert Koch-Institutes für die Hygienemaßnahmen und Infektionskontrolle bei Patienten mit bestätigter Infektion durch 2019-nCoV. In: Website des Robert Koch-Instituts. 7. Februar 2020, abgerufen am 8. Februar 2020.
- ↑ Kathrin Strobel: Was tun bei Verdacht auf Coronavirus 2019-nCoV? In: medical-tribune.de. Medical Tribune Deutschland, 28. Januar 2020, abgerufen am 28. Januar 2020.
- ↑ FAQs Coronavirus, Bundeszahnärztekammer. Abgerufen am 20. März 2020.
- ↑ Empfehlungen des Robert Koch-Instituts zur Meldung von Verdachtsfällen von COVID-19. Robert Koch-Institut, 14. Februar 2020, abgerufen am 5. März 2020.
- ↑ Epidemiegesetz 1950. Bundesrecht konsolidiert, Gesamte Rechtsvorschrift. In: RIS. 14. Juni 2018, abgerufen am 6. März 2020: „Der Anzeigepflicht unterliegen: […] (2) Der Bundesminister für Gesundheit und Frauen kann, […], durch Verordnung weitere übertragbare Krankheiten der Meldepflicht unterwerfen oder bestehende Meldepflichten erweitern.“
- ↑ 15. Verordnung des Bundesministers für Arbeit, Soziales, Gesundheit und Konsumentenschutz betreffend anzeigepflichtige übertragbare Krankheiten 2020. In: Bundesgesetzblatt für die Republik Österreich. 26. Januar 2020, abgerufen am 4. März 2020: „Der Anzeigepflicht nach dem Epidemiegesetz1950 unterliegen Verdachts-, Erkrankungs- und Todesfälle an 2019-nCoV („2019 neuartiges Coronavirus“).“
- ↑ Absonderungsverordnung. Bundesrecht konsolidiert: Gesamte Rechtsvorschrift für Absonderung Kranker, Krankheitsverdächtiger und Ansteckungsverdächtiger und Bezeichnung von Häusern und Wohnungen, Fassung vom 6. März 2020. In: RIS, Bundesrecht konsolidiert. 31. Januar 2020, abgerufen am 6. März 2020: „Bei Masern oder Infektion mit 2019-nCoV (“2019 neuartiges Coronavirus„) sind die Kranken und Krankheitsverdächtigen abzusondern oder nach den Umständen des Falles lediglich bestimmten Verkehrsbeschränkungen zu unterwerfen.“
- ↑ Verordnung vom 31. Jänner 2020. 21. Verordnung des Bundesministers für Soziales, Gesundheit, Pflege und Konsumentenschutz, mit der die Verordnung des Ministers des Innern im Einvernehmen mit dem Minister für Kultus und Unterricht vom 22. Februar 1915, betreffend die Absonderung Kranker, Krankheitsverdächtiger und Ansteckungsverdächtiger und die Bezeichnung von Häusern und Wohnungen geändert wird. In: Bundesgesetzblatt für die Republik Österreich. 31. Januar 2020, abgerufen am 6. März 2020: „In § 4 3. Satz wird nach dem Wort „Masern“ die Wortfolge „oder Infektion mit 2019-nCoV (“2019 neuartiges Coronavirus„)“ eingefügt.“
- ↑ Neues Coronavirus: Informationen für Gesundheitsfachpersonen. Verdachts- und Meldekriterien sowie Meldeformular. Bundesamt für Gesundheit, 5. März 2020, abgerufen am 5. März 2020.
- ↑ Bundesgesetz über die Bekämpfung übertragbarer Krankheiten des Menschen. Epidemiengesetz, EpG. Bundeskanzlei, 1. Januar 2017, abgerufen am 6. März 2020.
- ↑ Verordnung über die Bekämpfung übertragbarer Krankheiten des Menschen. (Epidemienverordnung, EpV) vom 29. April 2015 (Stand am 1. März 2019). Bundeskanzlei, abgerufen am 6. März 2020.
- ↑ Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. vom 1. Dezember 2015 (Stand am 1. Februar 2020). Bundeskanzlei, abgerufen am 6. März 2020.
- ↑ Meldeformulare. COVID-19 Meldung Update 4. März 2020. Bundesamt für Gesundheit, 4. März 2020, abgerufen am 5. März 2020.
- ↑ ICD-10 (WHO und GM): U07.1 kodiert COVID-19, Coronavirus-Krankheit-2019. Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), 17. Februar 2020, abgerufen am 29. Februar 2020.
- ↑ Coronaviren können für Haustiere gefährlich werden. 6. März 2020, abgerufen am 6. März 2020.
- ↑ 139,0 139,1 Q&A on coronaviruses (COVID-19). Abgerufen am 6. März 2020 (english).
- ↑ Covid-19: Können Haustiere das Coronavirus übertragen? 6. März 2020, abgerufen am 6. März 2020.
- ↑ 141,0 141,1 141,2 Coronavirus: Nein, Hunde erkranken nicht an Covid-19. In: Der Spiegel – Wissenschaft. Abgerufen am 6. März 2020.
- ↑ Weltorganisation für Tiergesundheit (OIE): Immediate notification. Tai Hang, Islands District, Hong Kong. Auf: oie.int vom 29. Februar 2020.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel COVID-19 aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |




