| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Influenzavirus
| Influenzavirus | ||||||||
|---|---|---|---|---|---|---|---|---|
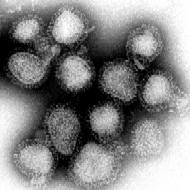
Influenzavirus A/Hong Kong/1/68 bei 70.000-facher Vergrößerung | ||||||||
| Systematik | ||||||||
| ||||||||
| Taxonomische Merkmale | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| Influenzavirus (engl.) | ||||||||
| Links | ||||||||
|
Die drei Gattungen Influenzavirus aus der Familie Orthomyxoviridae sind umhüllte Viren mit einer einzelsträngigen, segmentierten RNA von negativer Polarität als Genom. Unter den Gattungen finden sich auch die Erreger der Influenza oder „echten“ Grippe. Zu medizinischen Aspekten der Influenzaviren und Grippe-Erkrankung siehe Influenza.
Aufbau
Virion

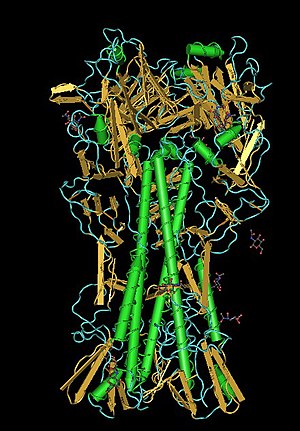
Das innerhalb der Lipidhülle (genauer: Virusmembran) befindliche Ribonucleoprotein des Virions, besitzt eine ungefähr helikale Symmetrie. Das Ribonucleoprotein ist ein Komplex aus dem Genom des Virus, den strukturellen (M1 und NP) und den replikationsrelevanten Proteinen (PA, PB1, PB2).
Im Transmissionselektronenmikroskop sieht man alle Gattungen dieses Virus als kugelige oder sphärisch ellipsoide (rundliche bis eiförmige), gelegentlich auch filamentöse (fadenförmige), umhüllte Viruspartikel mit einem Durchmesser von 80 bis 120 nm,[1] in deren Lipidhülle eine variierende Anzahl der drei Membranproteine HA, NA und M2 bei Influenza-A-Viren bzw. der zwei Membranproteine HA und NA bei Influenza-B-Viren oder der Hämagglutinin-Esterase-Faktor HEF und das Matrixprotein CM2 bei Influenza C eingelagert sind. Die Glykoproteine HA und NA ragen als 10 bis 14 nm lange Spikes oder Peplomere genannte Fortsätze über die Virusoberfläche von Influenza-A-Viren hinaus. Dagegen ragt das M2 von Influenza A nur mit 24 Aminosäuren aus der Lipiddoppelschicht heraus und wird unter der Überdeckung des HA und NA kaum von Antikörpern im Zuge einer Immunreaktion erkannt. Bei den Influenza-A- und Influenza-B-Viren sind daher genau zwei Typen dieser Spikes serologisch von besonderem Interesse: das Hämagglutinin (HA) und die Neuraminidase (NA), gegen die Antikörper nach einer Erkrankung und in geringerem Umfang auch nach einer Impfung mit einem Influenzaimpfstoff gegen Influenza A und B entstehen. Diese Antikörper können zur serologischen Klassifizierung der 16 HA- und 9 NA-Subtypen von Influenza-A-Viren herangezogen werden.
Genom
Das Genom fast aller Influenzaviren besteht aus acht RNA-Abschnitten (Segmenten) negativer Polarität, bei Influenza C sind es nur sieben. Diese acht RNA-Moleküle enthalten die genetische Information, die für die Vermehrung und den Zusammenbau der Viruspartikel benötigt wird und kommen im Virion bevorzugt einzelsträngig vor.[1] Die Segmentierung des Genoms ist auch für die erhebliche Steigerung der genetischen Veränderlichkeit (Variabilität) der Influenzaviren über die Fähigkeit zur genetischen Reassortierung (auch Antigen-Shift) verantwortlich, da bei einer Superinfektion einer Zelle (mit einem anderen Influenzastamm) ein Austausch der Segmente erfolgen kann. Durch das RNA-basierte einzelsträngige Genom kommen häufig Punktmutationen vor (sogenannter Antigen-Drift), denn die RNA-Polymerasen von RNA-Viren besitzen keine Exonuklease-Funktion zur Korrektur von Kopierfehlern. Durch beide Mechanismen entstehen Fluchtmutationen zur Umgehung der Immunantwort, während die Funktionen des Virions erhalten bleiben sollen. Das Genom erhält die stärkste Anpassung durch den vom Immunsystem ihrer Reservoirwirte erzeugten Selektionsdruck, wobei der Erhalt der Funktionen der Proteine für eine hohe Reproduktions- und Infektionsrate notwendig ist.
Die acht verschiedenen Segmente (HA, NA, M, NP, PA, PB1, PB2 und NS) kodieren bei Influenza A bis zu elf virale Proteine:[2] das Hämagglutinin (HA), die Neuraminidase (NA), das Nukleoprotein (NP), die Matrixproteine (M1) und (M2), die RNA-Polymerase (PA), die Polymerase-bindenden Proteine (PB1, PB2 und vereinzelt auch PB1-F2) und die Nichtstrukturproteine (NS1 und NS2). Das Genom von Influenza C besitzt nur sieben Segmente, es fehlt die Neuraminidase, da deren Funktion mit der Hämagglutinin-Funktion im HEF integriert ist.
Hüllproteine
Das Hämagglutinin (HA) ist ein Lektin und bewirkt die Verklumpung (Agglutination) von Erythrozyten und vermittelt bei der Infektion die Anheftung des Virions an eine Wirtszelle. Das Ankoppeln des Hämagglutinins an eine Zelle geschieht durch eine Anlagerung eines Teils des Hämagglutininmoleküls an Sialinsäuren (SA) auf Proteinen der Wirtszellenhülle, die als Rezeptoren (SA-Rezeptoren) fungieren. Diese Sialinsäuren sind bei Vögeln gehäuft α-2,3-verknüpft und bei Säugern gehäuft α-2,6-verknüpft.[3] Daneben unterscheiden sich die Verteilungen dieser Verknüpfungen in der Lunge in Säugern und Vögeln.[4] Jede Hämagglutininvariante passt dabei an einen bestimmten Wirtszellenrezeptor nach dem Schlüssel-Schloss-Prinzip, wobei jeder Wirt nur über einen Teil aller von Influenzaviren genutzten Rezeptoren verfügt. Diese Tatsache ist auch der Grund dafür, dass bestimmte Subtypen oder Virusvarianten mit ihrem speziellen Hämagglutinintyp bestimmte Wirte leicht infizieren und dabei eine Erkrankung auslösen können und andere prinzipiell mögliche Wirte wiederum nicht oder nur sehr eingeschränkt. Nach einer proteolytischen Aktivierung des von einer Zelle aufgenommenen Hämagglutinins durch zelluläre Serinpeptidasen und einer Ansäuerung des Endosoms bewirkt das Hämagglutinin auch über seine Fusionsdomäne eine Fusion mit der endosomalen Membran zur Freisetzung des Ribonucleoproteins ins Zytosol. Das Hämagglutinin ist aus drei gleichen Proteinen aufgebaut (ein Homotrimer). Mittels Proteolyse wird jeder dieser drei Teile (Monomere) wiederum in zwei Polypeptidketten gespalten, die jedoch über eine Disulfidbrücke miteinander verbunden bleiben. Diese Spaltung ist für die Fusion der Virusmembran mit der Endosomenmembran zwingend notwendig, nicht jedoch für die Rezeptorbindung. Durch Mutationen, besonders in Hinblick auf mögliche Veränderungen des Hämagglutinins, kann sich die Infektionsgefahr für den einen oder anderen potentiellen Wirt erheblich ändern. Allerdings können die Viren die HA-Bindungsstelle nicht beliebig verändern, da bei einem Funktionsverlust der Wiedereintritt in Zellen nicht mehr erfolgen kann und somit die Infektkette unterbrochen wird.[3] Vor allem gegen das Hämagglutinin werden neutralisierende Antikörper ausgebildet, die eine erneute Infektion mit demselben Virusstamm verhindern. Daher sind neu auftretende Epidemien meistens von Änderungen im Hämagglutinin begleitet.[5]
Die Neuraminidase (NA) hat im Infektionsvorgang eine enzymatische Funktion zur Abspaltung (Hydrolyse) der N-Acetylneuraminsäure (eine Sialinsäure) an zellulären Rezeptoren. Dadurch erfolgt die Freisetzung der durch die Replikation neu entstandenen Viren (Tochtervirionen aus den infizierten Zellen) und damit bei der Ausbreitung der Infektion sowohl innerhalb desselben Organismus als auch auf andere Organismen.[6] Außerdem verhindert die Neuraminidase ein Hämagglutinin-vermitteltes Anheften der Tochtervirionen an bereits infizierte Zellen. Daneben verhindert die Neuraminidase, dass in einer infizierten Zelle ein Zelltodprogramm gestartet werden kann, drosselt eine Bildung des Immunsystembotenstoffs Interferon und behindert damit eine Immunantwort des infizierten Organismus.[7] Oseltamivir, Zanamivir und Peramivir hemmen bei nicht-resistenten Influenza-A- und Influenza-B-Stämmen die Neuraminidase.
Das Matrixprotein 2 (M2) ist das kleinste Membranprotein von Influenza-A-Viren. Bei Influenza A besteht M2 aus circa 97 Aminosäuren, wovon 24 Aminosäuren aus der Membran herausragen. Das Matrixprotein M2 ist hier ein Protonenkanal zur Ansäuerung des Inneren des Virions nach einer Endozytose, so dass die Fusionsdomäne des Hämagglutinins ausgelöst wird und eine Verschmelzung von Virus- und Endosomenmembran zur Freisetzung des Ribonucleoproteins ins Zytosol erfolgen kann. Bei Influenza B-Viren ist das Matrixprotein 2 (BM2) kein Hüllprotein, sondern ein lösliches Protein von circa 109 Aminosäuren.[8] Bei Influenza C ist das entsprechende Matrixprotein CM2, wie bei Influenza A, ein Ionenkanal. Amantadin und Rimantadin hemmen bei nicht-resistenten Influenza-A-Stämmen das Matrixprotein M2.
Interne Proteine
Als weitere im Virion befindliche Proteine (Strukturproteine, engl. structural proteins) existieren neben den Hüllproteinen die internen Proteine (engl. core proteins). Der Bereich zwischen Virusmembran und Ribonucleoprotein wird als Matrix oder Viruslumen (lat. lumen für ‚Licht‘) bezeichnet, da er im Transmissionselektronenmikroskop aufgrund einer niedrigeren Elektronendichte heller als das Ribonucleoprotein erscheint. An der Innenseite der Virusmembran befinden sich die zytosolischen Anteile der drei Membranproteine HA, NA und M2, sowie das Matrixprotein M1, welches die Virusmembran mit dem Ribonucleoprotein verbindet, bei Ansäuerung aber das Nukleoprotein freisetzt. Das Ribonucleoprotein besteht aus dem Nucleoprotein NP, den viralen RNA-Segmenten und den für die Replikation und Transkription notwendigen Proteinen des Polymerase-Komplexes (PA, PB1 und PB2, mit A für acide oder B für basisch bezeichnet, je nach ihren isoelektrischen Punkten).[9] Das Nucleoprotein NP bindet neben dem Matrixprotein M1 an die virale RNA und vermittelt über sein Kernlokalisierungssignal den Transport in den Zellkern.[10] NS2 kommt in geringen Mengen gelegentlich auch im Virion vor.[11]
Nichtstrukturproteine
Die regulatorischen Proteine NS1, NS2 und das bei manchen Stämmen auftretende PB1-F2 kommen nicht im Virion vor und werden daher als Nichtstrukturproteine bezeichnet. Das NS1 mindert durch seine Bindung an PDZ-Domänen die Interferon-Reaktion des Wirtes und somit die Immunreaktion.[12] Daneben verhindert NS1 das Ausschleusen wirtseigener mRNA aus dem Zellkern durch Bindung ihrer Cap-Struktur, wodurch die virale RNA vermehrt in Proteine translatiert werden.[13] NS2 vermittelt den Export viraler mRNA aus dem Zellkern.[14] PB1-F2 fördert die korrekte Lokalisation des PB1 im Zellkern und bindet an die Polymerase PA und fördert über den mitochondrialen Weg die Einleitung der Apoptose zur Verbesserung der Freisetzung der Tochtervirionen.[15]
Wirtsrestriktion
Die Koevolution von Menschen und Viren (in diesem Falle von RNA-Viren) hat im Menschen antivirale Mechanismen hervorgebracht, die als Wirtsrestriktions- oder auch Resistenzfaktoren (engl. host restriction factors) bezeichnet werden. Hierzu zählen bei Influenzaviren der Myxovirus-Resistenzfaktor Mx1, die Toll-like Rezeptoren 3, 7 und 8, RIG-I, der dsRNA-aktivierte Inhibitor der Translation DAI, MDA5, die Oligoadenylatsynthase OAS1, das Nod-like Receptor Protein 3 (NLRP-3) und die Proteinkinase R.
Replikationszyklus
Die Influenzaviren werden beim Menschen im Atemtrakt (Respirationstrakt) eines infizierten Individuums repliziert. Menschliche Grippeviren bevorzugen gemäß IMPP Zellen des Flimmerepithels. Im Gegensatz dazu vermehrt sich das Grippe-Virus bei Vögeln hauptsächlich in den Darmepithelzellen.[16]
Die Viren wandern bei ihrem Wirt durch das Mucin in die Epithelzellen, die als Wirtszellen dienen. Dafür, dass sie dabei nicht mit dem Schleim verkleben, sorgt die Neuraminidase.[17] Nach der Bindung des Hämagglutinins an eine N-Acetyl-Neuraminsäure auf einer Zelloberfläche erfolgt die Einstülpung des Virions durch Endocytose. Im Endosom schneiden zelluläre Serinproteasen das Hämagglutinin in seine aktivierte Form. Daneben sinkt der pH-Wert im Endosom, wodurch über das Ionenkanalprotein M2 das Innere des Virions angesäuert wird. Die Ansäuerung löst die Fusionsdomäne des Hämagglutinins aus, wodurch die Virusmembran mit der Endosomenmembran verschmilzt und das Ribonukleoprotein ins Zytosol freigesetzt wird, gleichzeitig löst sich M1 vom Ribonukleoprotein, wodurch dessen Kernlokalisierungssignale exponiert werden. Das Ribonukleoprotein wird durch einen zellulären Abbaumechanismus, das Aggregosom, vom Matrixprotein befreit, vermutlich unter Verwendung von zelleigenen Motorproteinen.[18] Über die Kernlokalisierungssequenz des Nucleoproteins erfolgt anschließend ein Import des Ribonucleoproteins in den Zellkern. Die Kopie der viralen RNA erfolgt durch den viralen Polymerasekomplex unter Verwendung der Ribonukleotide des Wirts. Durch das NS2-Protein wird die vervielfältigte virale RNA aus dem Zellkern ins Zytosol geschleust, wo nach der RNA-Vorlage am Ribosom Proteine hergestellt werden. Die strukturellen Proteine binden aneinander und das NP-Protein bindet die virale RNA, wodurch sich das Virion zusammenfügt. Influenzaviren sind lytische Viren und verlassen die Wirtszelle durch Zerstörung ebendieser.
In einer einzigen infizierten Wirtszelle können sich bis zu etwa 20.000 neue Influenzaviren bilden (englisch burst size ‚Berstgröße‘), bevor diese dann abstirbt und anschließend die freigesetzten Viren weitere Nachbarzellen infizieren. In infizierten Zellkulturen oder embryonierten Hühnereiern wurden virusstammabhängige Werte zwischen 1.000 und 18.755 Tochtervirionen pro Zelle ermittelt.[19][20][21] Diese produzieren dann ebenfalls jeweils viele Tausende neuer Viren. So erklärt sich auch die Schnelligkeit, mit der sich in der Regel diese virale Infektion im Körper eines Betroffenen ausbreitet.
Systematik
Es gibt drei verschiedene Gattungen dieser Viren, welche mit den Gattungen Thogotovirus und Isavirus alle zusammen zur Familie der Orthomyxoviren gehören.
- Influenzavirus A
- Die lineare, einzelsträngige RNA ihres Genoms besitzt acht Segmente und sie zeichnen sich besonders durch große Unterschiede in den antigenen Eigenschaften aus, die im Vergleich zu den anderen Gattungen auf besonders hoher Mutationsfrequenz und Neugruppierungen beruhen. Diese Untertypen befallen üblicherweise jeweils nur bestimmte Wirte und innerhalb derer bestimmte Zellarten (siehe Tropismus). Dazu zählen der Mensch und verschiedene Säugetierarten wie Schweine (siehe unter Schweineinfluenza), Pferde (siehe unter Pferdeinfluenza), Nerze, Seehunde und Wale, Haushunde, einige Katzenarten und zahlreiche Vogelarten.[22] Das primäre Reservoir aller Influenza-A-Viren liegt im Wassergeflügel.[23] Alle 16 HA- und alle 9 NA-Serotypen von Influenza A können Vögel infizieren.[24]
- Influenzavirus B
- Ihr Genom hat ebenfalls eine acht-fach segmentierte lineare, einzelsträngige RNA und sie befallen nur Menschen[25] und Seehunde.[26][27]
- Influenzavirus C
- Im Gegensatz zu den Influenza-A- und B-Viren hat die lineare, einzelsträngige RNA des Genoms der Influenza-C-Viren nur sieben Segmente und sie besitzen keine Neuraminidase (NA). Außerdem liegt bei diesen Viren ein Oberflächen-Glykoprotein Haemagglutinin-Esterase-Fusion-Protein (HEF) vor, das sowohl die Aufgaben der Rezeptorbindung des Virus an die Wirtszelle, der anschließenden Eindringung (Fusion) wie auch der späteren Freisetzung der neugebildeten Viren aus der Zelle übernimmt. Dieses Virus vom Typ C befällt Menschen und Schweine (siehe ebenfalls unter Schweineinfluenza), doch spielt er bei Erkrankungen des Menschen keine relevante Rolle, da er, wenn überhaupt, nur zu milden Erkrankungen führt.
In Fachkreisen wird jeder Virusstamm mit den Kennungen Typus, Ort der erstmaligen Isolierung (Virusanzucht), Nummer des Isolats, Isolierungsjahr (Beispiel: Influenza B/Shanghai/361/2002) und nur bei den A-Viren auch zusätzlich mit der Kennung des Oberflächenantigens benannt [Beispiel: Influenza A/California/7/2004 (H3N2)].
Variabilität und Subtypen
Antigendrift
Eine Häufung von Punktmutationen in den Nukleotiden führt zu einer Veränderung der Erbinformationen (Gendrift). Betreffen solche Veränderungen die beiden Glykoproteine HA und NA (bzw. den sie kodierenden Bereich) bewirkt dies eine Änderung der Oberflächenantigene des Grippevirus (Antigendrift). Menschliche Antikörper können immer nur eine solche Variante erkennen. Diese eher kleinen Veränderungen sind der Grund dafür, dass ein Mensch mehrmals in seinem Leben mit einer anderen nur geringfügig veränderten Virusvariante (Driftvariante) infiziert werden kann und dass sowohl Epidemien wie regional begrenzte Ausbrüche regelmäßig wiederkehren. Daher ist es ein Ziel des Influenza-Impfstoffdesigns, breitneutralisierende Antikörper hervorzurufen. Nach mehreren überstandenen Infektionen mit unterschiedlichen Stämmen kommt es langfristig zu einem Anstieg der Titer von breitneutralisierenden Anti-Influenza-Antikörpern, möglicherweise aufgrund der hohen genetischen Variabilität der Influenzavirusstämme.[28] Die Mutationsrate des Influenzavirus A liegt bei 0,000015 Mutationen pro Nukleotid und Replikationszyklus.[29]
Antigenshift
Wird ein Organismus gleichzeitig von zwei Virusvarianten infiziert (Doppelinfektion) oder es tauschen zwei Viren gleichen Ursprungs unterschiedliche mutierte Gensegmente aus (wobei im letzteren Fall die Veränderungen geringer ausfallen), so kann es zu einer Neuzusammenstellung unter den zweimal acht Genomsegmenten der beteiligen Influenzaviren kommen, in dem einzelne oder mehrere RNA-Moleküle zwischen den Influenzaviren in einer doppelt infizierten Zelle ausgetauscht werden. Diesen Vorgang nennt man genetische Reassortierung, und sie kann im Menschen, aber auch in anderen Wirten, wie beispielsweise bei Vögeln und Schweinen erfolgen. Die so verursachten größeren, als Antigenshift bezeichnete Veränderungen in den viralen Oberflächenantigenen werden allein bei den Influenza-A-Viren beobachtet (Shiftvarianten), allerdings kommen sie nur selten vor. Derartige Veränderungen können dann der Ursprung von Pandemien sein, von denen es im 20. Jahrhundert die von 1918 bis 1919 mit dem Subtyp H1N1, 1957 mit H2N2, 1968 mit H3N2 und die von 1977 mit dem Wiederauftauchen von H1N1 gab.
Influenza-A-Subtypen
Im Allgemeinen werden die Influenza-A-Viren in erster Linie serologisch eingeteilt. Dies geschieht nach dem Muster A/HxNx oder A/Isolierungsort/Isolat/Jahr (HxNx). Bisher wurden insgesamt 16 H-Untertypen und 9 N-Untertypen erkannt. Eine als H17 bezeichnete Variante wurde 2012 erstmals bei Fledermäusen in Guatemala nachgewiesen.[30]
Die wichtigsten Oberflächenantigene beim Influenza-A-Virus für die Infektion des Menschen sind die Hämagglutinin-Serotypen H1, H2, H3, H5, seltener H7 und H9 und die Neuraminidase-Serotypen N1, N2, seltener N7, weshalb auch folgende Subtypen für den Menschen von besonderer Bedeutung sind:
- Influenza-A-Virus H1N1
- Eine Variante von A/H1N1 konnte als Auslöser der so genannten Spanischen Grippe von 1918/1920 im Lungengewebe von Opfern nachgewiesen werden. 2005 gelang Jeffery Taubenberger eine Rekonstruktion des Erregers der Spanischen Grippe aus Genfragmenten. Ein erneuter weltweiter Ausbruch – die so genannte Russische Grippe – ereignete sich 1977.[31] Im April 2009 ereignete sich in Mexiko ein epidemieartiger Ausbruch einer bis dahin unbekannten Variante des H1N1-Subtyps, an dem zahlreiche Menschen erkrankten (siehe: Pandemie H1N1 2009/10). Da der erste Nachweis von A/ H1N1 im Jahr 1930 aus Schweinen erfolgte,[32][33] werden durch diesen Subtyp verursachte Infektionen beim Schwein als Schweineinfluenza bezeichnet.
- A/H2N2
- Ein weltweiter Ausbruch dieses Subtyps der Humaninfluenza war 1957 die Ursache einer Pandemie, die als Asiatische Grippe bezeichnet wurde.
- A/H3N2
- Ein weltweiter Ausbruch dieses Subtyps (Fujian Typ) war 1968 die Ursache einer Pandemie, die als Hongkong-Grippe bezeichnet wurde.
- Influenza-A-Virus H5N1
- Dieser Subtyp ist bislang nur in sehr seltenen Einzelfällen von Mensch zu Mensch übertragbar, gleichwohl gab es seit 2003 mehrere hundert von der WHO gemeldete Todesfälle (→ Vogelgrippe H5N1).
- A/H7N2
- Dieser Subtyp wurde 2002 in den USA erstmals auf den Menschen übertragen.
- A/H7N3
- In Kanada wurde im Februar 2004 die Präsenz von H7N3 in mehreren Putenfarmen in British Columbia nachgewiesen. Zwei Menschen infizierten sich mit dem Subtyp, beide überstanden die Infektion ohne Folgen. Die Symptome sind ähnlich der einer leichten Grippe.[34][35]
- A/H7N7
- 2003 wurden in den Niederlanden 89 Infektionen von Menschen mit diesem Subtyp bestätigt. Ein Fall verlief tödlich. Das Virus kann auch Pferde befallen.[36]
- A/H7N9
- Vermutlich nach Kontakt mit infiziertem Geflügel kam es im Februar 2013 erstmals beim Menschen zu Infektionen mit dem Influenza-A-Virus H7N9 und als deren Folgen zu Todesfällen durch die sogenannte Vogelgrippe H7N9 aufgrund schwerer Pneumonien durch eine bis dahin unbekannte, reassortierte Variante des Virus A/H7N9.[37]
- A/H9N2
- Dieser Subtyp wurde bislang beim Menschen nur in einer minder pathogenen Form (LPAI, Lowly Pathogenic Avian Influenza) von Peiris et al. (1999) isoliert und dokumentiert. Bei drei Fällen in Hongkong und China (1999, 2003) erholten sich die Patienten von dieser influenzaähnlichen Infektion.[38]
- A/H10N8
- Dieser Subtyp rief erstmals Ende Dezember 2013 weltweite Aufmerksamkeit hervor, nachdem in Südchina eine 74-jährige Frau an den Folgen einer Infektion mit A/H10N8 verstorben war; wenig später wurde aus dem gleichen Gebiet eine weitere Infektion bekannt.[39] Zuvor war dieser Subtyp vor allem in südchinesischem Geflügel und in Zugvögeln – auch in den USA und in Europa – nachgewiesen worden.[40] Bereits im Juli 2012 war die Sequenzierung des Genoms aus einer chinesischen Virusprobe von A/H10N8 publiziert worden.[41]
Influenza-B-Subtypen
Die Influenza-B-Viren werden in zwei Stamm-Linien eingeteilt:
- B/Victoria-Linie
- B/Yamagata-Linie
Influenza-C-Subtypen
Die Unterschiede zwischen einzelnen Virusstämmen sind derart gering, dass hier bislang keine weitere Unterteilung vorgenommen wurde.
Umweltstabilität
Je nach Temperatur ist die Umweltstabilität (synonym Tenazität) der Influenzaviren sehr unterschiedlich. Bei einer normalen sommerlichen Tagestemperatur von etwa 20 °C können an Oberflächen angetrocknete Viren in der Regel zwei bis acht Stunden überdauern. Bei 22 °C überstehen sie sowohl in Exkrementen wie auch in Geweben verstorbener Tiere und in Wasser mindestens vier Tage, bei einer Temperatur von 0 °C mehr als 30 Tage und im Eis sind sie nahezu unbegrenzt überdauerungsfähig. Forscher der NIH in den USA stellten 2008 fest, dass die Lipidhülle des Influenza-Virus sich bei tieferen Temperaturen verändert. Damit wird das Virus stabilisiert und bleibt länger pathogen.[42]
Oberhalb von 22 °C verringert sich allerdings die Umweltstabilität der Influenzaviren sehr deutlich. Bei 56 °C werden sie innerhalb von 3 Stunden und bei 60 °C innerhalb von 30 Minuten inaktiviert.[43] Ab 70 °C verliert das Virus endgültig seine Infektiosität.
Als behülltes Virus ist das Influenza-A-Virus empfindlich gegenüber Detergentien[44][45] und organischen Lösemitteln wie Alkoholen (z. B. Ethanol, Isopropanol).[44][45] Die metastabile Fusionsdomäne des Hämagglutinins kann durch Säuren irreversibel ausgelöst werden.[46] Darüber hinaus kann auch eine chemische oder physikalische Denaturierung zu einem Funktionsverlust der viralen Proteine führen.[47] Durch die Vielzahl an effektiven Desinfektionsmechanismen sind Influenzaviren relativ instabil im Vergleich zu anderen Viren (z. B. das Poliovirus oder das Hepatitis-B-Virus).
Vorkommen
Beim Menschen existieren die Influenzaviren und die durch sie ausgelösten Erkrankungen weltweit, allerdings kommen im Gegensatz zu den anderen Virustypen die Influenza-C-Viren nur gelegentlich vor. Während sich die Infektionen in gemäßigten Klimazonen mit zwei Hauptwellen im Oktober/November und im Februar/März manifestieren, ist die Infektionshäufigkeit in tropischen Gefilden konstant mit einem oder zwei Höhepunkten in der Regenzeit.
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 R. A. Lamb, P. W. Choppin: The gene structure and replication of influenza virus. In: Annu. Rev. Biochem. Nr. 52, 1983, S. 467–506, doi:10.1146/annurev.bi.52.070183.002343, PMID 6351727.
- ↑ Renate König et al.: Human host factors required for influenza virus replication. In: Nature. Band 463, 2010, S. 813–817, doi:10.1038/nature08699
- ↑ 3,0 3,1 Zhi-Yong Yang, Chih-Jen Wei, Wing-Pui Kong, Lan Wu, Ling Xu, David F. Smith, Gary J. Nabel: Immunization by Avian H5 Influenza Hemagglutinin Mutants with Altered Receptor Binding Specificity. In: Science. 317, Nr. 5837, 2007-08-10 ISSN 0036-8075, S. 825–828, doi:10.1126/science.1135165.
- ↑ L. Yao, C. Korteweg, W. Hsueh, J. Gu: Avian influenza receptor expression in H5N1-infected and noninfected human tissues. In: FASEB J. (2008), Bd. 22(3), S. 733–40. PMID 17925493.
- ↑ R. G. Webster, W. G. Laver: The origin of pandemic influenza. In: Bull World Health Organ. (1972), Band 47(4), S. 449–52. PMID 4540994; PMC 2480853 (freier Volltext).
- ↑ Y. Suzuki: Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses. In: Biol Pharm Bull. Bd. 28, 2005, Nr. 3, S. 399–408, doi:10.1248/bpb.28.399, PMID 15744059.
- ↑ Berliner Zeitung
- ↑ S. E. Lindstrom, Y. Hiromoto, H. Nishimura, T. Saito, R. Nerome, K. Nerome: Comparative analysis of evolutionary mechanisms of the hemagglutinin and three internal protein genes of influenza B virus: multiple cocirculating lineages and frequent reassortment of the NP, M, and NS genes. In: Journal of virology. (J. Virol.) 1999, Bd. 73, Nr. 5, S. 4413–4426, PMID 10196339, PMC 104222 (freier Volltext).
- ↑ M. R. Hilleman: Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. In: Vaccine Bd. 20, 2002, Nr. 25-26, S. 3068–87, PMID 12163258.
- ↑ K. Martin, A. Helenius: Transport of incoming Influenza Virus Nucleocapsids into the Nucleus. In: J. Virol. 1991, Bd. 56, Nr. 1, S. 232, PMID 1985199.
- ↑ D. M. Knipe, Peter M. Howley (Hrsg.): Fields Virology. 4. Auflage, Philadelphia 2001, ISBN 0-7817-6060-7.
- ↑ K. Haye, S. Bourmakina, T. Moran, A. García-Sastre, A. Fernandez-Sesma: The NS1 protein of a human influenza virus inhibits type I interferon production and the induction of antiviral responses in primary human dendritic and respiratory epithelial cells. In: J Virol. 2009, Bd. 83, Nr. 13, S. 6849–62, PMID 19403682.
- ↑ B. G. Hale, R. E. Randall, J. Ortín, D. Jackson: The multifunctional NS1 protein of influenza A viruses. In: J Gen Virol. 2008, Bd. 89, Nr. 10, S. 2359–2376, PMID 18796704.
- ↑ N. C. Robb,´M. Smith, F. T. Vreede, E. Fodor: NS2/NEP protein regulates transcription and replication of the influenza virus RNA genome. J Gen Virol. 2009, Bd. 90, Teil 6, S. 1398-407, PMID 19264657.
- ↑ I. Mazur, D. Anhlan, D. Mitzner, L. Wixler, U. Schubert, S. Ludwig: The proapoptotic influenza A virus protein PB1-F2 regulates viral polymerase activity by interaction with the PB1 protein. In: Cell Microbiol. 2008, Bd. 10, Nr. 5, S. 1140–1152, PMID 18182088.
- ↑ Univ.-Prof. Mag.pharm. Dr. Franz X. Heinz: Dem Geheimnis der Influenza Pandemien auf der Spur., abgerufen 9. Januar 2013
- ↑ Der Lebenszyklus des Influenza-Virus – eine erste Übersicht., Abgerufen am 9. Januar 2013.
- ↑ I. Banerjee, Y. Miyake, S. P. Nobs, C. Schneider, P. Horvath, M. Kopf, P. Matthias, A. Helenius, Y. Yamauchi: Influenza A virus uses the aggresome processing machinery for host cell entry. In: Science (New York, N.Y.). Band 346, Nummer 6208, Oktober 2014, S. 473–477, ISSN 1095-9203. doi:10.1126/science.1257037. PMID 25342804.
- ↑ S. J. Stray, G. M. Air: Apoptosis by influenza viruses correlates with efficiency of viral mRNA synthesis. In: Virus research. Band 77, Nummer 1, September 2001, ISSN 0168-1702, S. 3–17, PMID 11451482.
- ↑ L. Möhler, D. Flockerzi, H. Sann, U. Reichl: Mathematical model of influenza A virus production in large-scale microcarrier culture. In: Biotechnology and bioengineering. Band 90, Nummer 1, April 2005, ISSN 0006-3592, S. 46–58, doi:10.1002/bit.20363, PMID 15736163.
- ↑ H. J. Cairns, M. Edney, S. Fazekas de St Groth: Quantitative aspects of influenza virus multiplication. In: Journal of immunology (Baltimore, Md. : 1950). Band 69, Nummer 2, August 1952, ISSN 0022-1767, S. 155–181, PMID 14946411.
- ↑ M. J. Pantin-Jackwood, D. E. Swayne: Pathogenesis and pathobiology of avian influenza virus infection in birds. In: Rev Sci Tech. Bd. 28, 2009, Nr. 1, S. 113–36, PMID 19618622.
- ↑ T. W. Vahlenkamp, T. C. Harder: Influenza virus infections in mammals. In: Berl Munch Tierarztl Wochenschr. Bd. 119, 2006, Nr. 3-4, S. 123–31, PMID 16573202.
- ↑ H. M. Yassine, C. W. Lee, R. Gourapura, Y. M. Saif: Interspecies and intraspecies transmission of influenza A viruses: viral, host and environmental factors. In: Anim Health Res Rev. Bd. 11, 2010, Nr. 1, S. 53–72, PMID 20591213.
- ↑ R. J. Webby, R. G. Webster, J. A. Richt: Influenza viruses in animal wildlife populations. In: Curr Top Microbiol Immunol. Nr. 315, 2007, S. 67–83, PMID 17848061.
- ↑ Osterhaus AD, Rimmelzwaan GF, Martina BE, Bestebroer TM, Fouchier RA: Influenza B virus in seals. In: Science. 288, Nr. 5468, 2000, S. 1051–3. doi:10.1126/science.288.5468.1051. PMID 10807575.
- ↑ Bodewes R, Morick D, de Mutsert G, Osinga N, Bestebroer T, van der Vliet S, Smits SL, Kuiken T, Rimmelzwaan GF, Fouchier RA, Osterhaus AD: Recurring influenza B virus infections in seals. In: Emerg Infect Dis.. 19, Nr. 3, 2013, S. 511–2. doi:10.3201/eid1903.120965. PMID 23750359.
- ↑ M. S. Miller, T. J. Gardner, F. .. Krammer, L. C. Aguado, D. .. Tortorella, C. F. Basler, P. .. Palese: Neutralizing Antibodies Against Previously Encountered Influenza Virus Strains Increase over Time: A Longitudinal Analysis. In: Science Translational Medicine. 5, 2013, S. 198ra107–198ra107, doi:10.1126/scitranslmed.3006637.
- ↑ J. D. Parvin, A. Moscona, W. T. Pan, J. M. Leider, P. Palese: Measurement of the mutation rates of animal viruses: influenza A virus and poliovirus type 1. In: Journal of virology. Band 59, Nummer 2, August 1986, ISSN 0022-538X, S. 377–383, PMID 3016304, PMC 253087 (freier Volltext).
- ↑ Suxiang Tong et al.: A distinct lineage of influenza A virus from bats. In: PNAS. Band 109, Nr. 11, 2012, S. 4269–4274, doi:10.1073/pnas.1116200109
- ↑ Informationen zur Vogelgrippe
- ↑ Richard E. Shope: Swine Influenza: III. Filtration and Ion Experiments and Etiology. In: Journal of Experimental Medicine. Band 54, 1931, S. 373–385.
- ↑ Suburban Emergency Management Project (Memento vom 4. März 2010 im Internet Archive), Biot Report 162 vom 9. Januar 2005: What Is Swine Flu?
- ↑ S. Aleina Tweed, Danuta M. Skowronski, Samara T. David, Andrew Larder, Martin Petric, Wayne Lees et al.: Human Illness from Avian Influenza H7N3, British Columbia. In: Emerging Infectious Diseases. 10, Nr. 12, 2004-11 ISSN 1080-6059 (online hier).
- ↑ Martin Hirst, Caroline R. Astell, Comments Malachi Griffith, Shaun M. Coughlin, Michelle Moksa, Thomas Zeng et al.: Novel Avian Influenza H7N3 Strain Outbreak, British Columbia. In: Emerging Infectious Diseases. 10, Nr. 12, 2004-11 ISSN 1080-6059 (online hier).
- ↑ Scott Krauss, Robert G. Webster: Predicting the Next Influenza Virus. In: Science. Band 337, Nr. 6095, 2012, S. 644, doi:10.1126/science.337.6095.644-a
- ↑ World Organisation for Animal Health vom 4. April 2013: Low pathogenic avian influenza (poultry), China (People's Rep. of). Information received on 04/04/2013 from Dr Zhang Zhongqui, Director General, China Animal Disease Control Centre, Veterinary Bureau, Ministry of Agriculture, Beijing, China (People's Rep. of).
- ↑ cdc.gov vom 23. Mai 2008: Avian Influenza A Virus Infections of Humans / Instances of Avian Influenza A Virus Infections of Humans.
- ↑ Avian influenza A (H10N8) who.int vom 30. Januar 2014.
- ↑ CDC issues alert after H10N8 bird flu found in China. Teipei Times vom 27. Januar 2014.
- ↑ Peirong Jiao et al.: Complete Genome Sequence of an H10N8 Avian Influenza Virus Isolated from a Live Bird Market in Southern China. In: Journal of Virology. Band 86, Nr. 14, 2012, S. 7716, doi:10.1128/JVI.00959-12
- ↑ Ivan V. Polozov, Ludmila Bezrukov, Klaus Gawrisch und Joshua Zimmerberg: Progressive ordering with decreasing temperature of the phospholipids of influenza virus. In: Nature Chemical Biology. Bd. 4, 2008, S. 248–255, PMID 18311130.
- ↑ Akademie für öffentliches Gesundheitswesen Düsseldorf (Hrsg.): Blickpunkt öffentliche Gesundheit. Nr. 04/2001.
- ↑ 44,0 44,1 M. L. Grayson, S. Melvani, J. Druce, I. G. Barr, S. A. Ballard, P. D. Johnson, T. Mastorakos, C. Birch: Efficacy of soap and water and alcohol-based hand-rub preparations against live H1N1 influenza virus on the hands of human volunteers. In: Clin Infect Dis. 2009, Bd. 48, Nr. 3, S. 285–91, PMID 19115974.
- ↑ 45,0 45,1 E. K. Jeong, J. E. Bae, I. S. Kim: Inactivation of influenza A virus H1N1 by disinfection process. In: Am J Infect Control. 2010, Bd. 38, Nr. 5, S. 354–60, PMID 20430477.
- ↑ M. Nishide, K. Tsujimoto, M. Uozaki, K. Ikeda, H. Yamasaki, A. H. Koyama, T. Arakawa: Effects of electrolytes on virus inactivation by acidic solutions. In: Int J Mol Med. 2011, Bd. 27, Nr. 6, S. 803–9, doi:10.3892/ijmm.2011.668, PMID 21468540.
- ↑ M. Abe, K. Kaneko, A. Ueda, H. Otsuka, K. Shiosaki, C. Nozaki, S. Goto: Effects of several virucidal agents on inactivation of influenza, Newcastle disease, and avian infectious bronchitis viruses in the allantoic fluid of chicken eggs. In: Jpn J Infect Dis. 2007, Band 60, Nr. 6, S. 342–6, PMID 18032831.
| Dieser Artikel basiert ursprünglich auf dem Artikel Influenzavirus aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |