| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
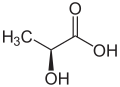
Milchsäure
| Strukturformel | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||
| Strukturformel ohne Angabe der Stereochemie | |||||||||||||||||
| Allgemeines | |||||||||||||||||
| Name | Milchsäure | ||||||||||||||||
| Andere Namen |
| ||||||||||||||||
| Summenformel | C3H6O3 | ||||||||||||||||
| CAS-Nummer |
| ||||||||||||||||
| PubChem | 612 | ||||||||||||||||
| ATC-Code | |||||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose, ölige Flüssigkeit (Racemat)[1] | ||||||||||||||||
| Eigenschaften | |||||||||||||||||
| Molare Masse | 90,08 g · mol−1 | ||||||||||||||||
| Aggregatzustand |
flüssig (Racemat) | ||||||||||||||||
| Dichte |
1,21 g · cm−3 (Racemat)[1] | ||||||||||||||||
| Schmelzpunkt |
| ||||||||||||||||
| Siedepunkt | |||||||||||||||||
| Dampfdruck | |||||||||||||||||
| pKs-Wert |
3,90 (25 °C)[2] | ||||||||||||||||
| Löslichkeit | |||||||||||||||||
| Brechungsindex |
1,4392 (20 °C; Racemat)[3] | ||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||
| |||||||||||||||||
| Toxikologische Daten | |||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||
Milchsäure (lat. acidum lacticum) ist eine Hydroxycarbonsäure, also eine Alkansäure, die sowohl eine Carboxygruppe als auch eine Hydroxygruppe besitzt. Sie wird deswegen auch als 2-Hydroxypropionsäure bezeichnet, nach den Nomenklaturempfehlungen der IUPAC ist jedoch die Bezeichnung 2-Hydroxypropansäure zu verwenden.
Die Salze und Ester der Milchsäure heißen Lactate.
Aufgrund ihrer unterschiedlichen optischen Aktivität wird die D-(−)-Milchsäure (Syn.: (R)-Milchsäure) auch als linksdrehende Milchsäure und die L-(+)-Milchsäure (Syn.: (S)-Milchsäure) auch als rechtsdrehende Milchsäure bezeichnet. Racemische Milchsäure ist ein 1:1-Gemisch aus (R)- und (S)-Milchsäure.
Milchsäure ist in Form von Lactat ein wichtiges Zwischenprodukt im Stoffwechsel, zum Beispiel als Produkt beim Abbau von Zuckern durch die Milchsäuregärung. Weltweit werden jährlich etwa 250.000 Tonnen Milchsäure produziert,[6] die vor allem in der Lebensmittelindustrie sowie zur Herstellung von Polylactiden (PLA; auch: Polymilchsäuren) genutzt werden.
Geschichte
Milchsäure wurde historisch sowohl in Europa wie auch in Asien zur Säuerung und Konservierung von Lebensmitteln, insbesondere für Milch (Sauermilch), Gemüse (bsp. Sauerkraut) und auch zur Herstellung von Silagen als Futtermittel bereits seit Jahrhunderten oder Jahrtausenden genutzt.
Die erste Entdeckung und Isolierung der Milchsäure geht auf den schwedischen Chemiker Carl Wilhelm Scheele im Jahr 1780 zurück, der sie aus saurer Milch in Form eines braunen Sirups isolierte.[7] Die Fleischmilchsäure [L-(+)-Milchsäure] wurde von Jöns Jakob Berzelius im Jahr 1808 entdeckt und ihre Struktur 1873 von Johannes Wislicenus aufgeklärt. Henri Braconnot, ein französischer Chemiker, fand 1813 heraus, dass Milchsäure in einem Fermentationsprozess hergestellt werden kann.[7] 1856 entdeckte Louis Pasteur die Milchsäurebakterien und entwickelte das Grundverständnis für die Milchsäuregärung. Die großtechnische Produktion von Milchsäure begann 1881 in den USA,[7] und 1895 machte auch Boehringer Ingelheim die Entdeckung, wie Milchsäure mit Hilfe von Bakterien in großen Mengen hergestellt werden konnte.
Vorkommen
L-(+)-Milchsäure kommt im Schweiß, Blut, im Muskelserum, der Niere, Galle und im Speichel vor. Das Racemat, d. h., die 1:1-Mischung aus D- und L-Form der Milchsäure stammt aus Sauermilchprodukten, Tomatensaft, Bier. Auch Pilze erzeugen Milchsäure, etwa Vertreter der Gattungen Rhizopodus, Allomyces, Blastocladiella u. a.[8]
Eigenschaften
Der spezifische Drehwert beträgt für D-Milchsäure bei 20 °C [α]D20 = –2,6 (H2O) und für L-Milchsäure [α]D20 = +2,6 (H2O). Bei 15 °C wird für L-Milchsäure ein Drehwert [α]D15 = +3,82 (H2O)[2] gemessen.
Milchsäure bildet intermolekular Ester. Unter Abspaltung von Wasser entsteht als dimere Verbindung Lactoylmilchsäure, die beim längeren Stehen oder beim Erhitzen zu Polymilchsäure weiterverestert. Diese Makromoleküle erreichen jedoch keine relevanten Kettenlängen, um das Produkt technisch verwerten zu können.
In wässriger Milchsäurelösung liegt ein chemisches Gleichgewicht zwischen Milchsäure und ihren Estoliden vor. In 90-%iger Milchsäurelösung findet man etwa 70 % als freie Säure und 20 % als ihre Estolide vor. Aus zwei Milchsäuremolekülen entstehen unter Ringschluss und Abspaltung von zwei Wassermolekülen Dilactid mit einem sechsgliedrigen Ring (Dilacton). Diese Verbindung ist in wässriger Milchsäurelösung jedoch nicht enthalten. Aus Dilactiden lassen sich mittels Ringöffnungspolymerisation hochwertige Polyester erzeugen. Der entstehende Kunststoff ist biologisch abbaubar und zudem immunologisch neutral.
Herstellung
Die Herstellung von Milchsäure kann sowohl biotechnologisch über eine Fermentation von Kohlenhydraten (Zucker, Stärke) wie auch synthetisch auf der Basis petrochemischer Rohstoffe (Acetaldehyd) erfolgen.
Fermentative Herstellung
Etwa 70 bis 90 % der Weltproduktion an Milchsäure wird derzeit fermentativ hergestellt,[9] wobei beide reinen Enantiomere kommerziell durch Fermentationsverfahren mit Milchsäurebakterien in signifikanten Mengen produziert werden.[10] Biologisch entsteht bei der mikrobiellen Fermentation durch Lactobakterien häufig das Racemat der Milchsäure (50:50-Gemisch) bis zu Produkten mit Anteilen von 51 bis 90 % L-Milchsäure.[11]
Industriell erfolgt die Herstellung von Sauermilchprodukten durch Vergärung von Milch oder Molke vor allem durch Lactobacillus casei, Lactobacillus bulgaricus und Lactobacillus helveticus, während für industriell genutzte Milchsäure Zuckerdicksaft oder Stärkehydrolysate und Lactobacillus delbrueckii sowie Pentose-haltige Sulfitablaugen und Lactobacillus pentosus verwendet werden.[12] Die Bakterienstämme werden nach ihrer Eigenart eingeteilt, Glucose nur zu Lactat oder auch zu anderen Produkten zu vergären: homofermentative Stämme, wie Lactobacillus casei und Lactococcus lactis, bilden pro Mol Glucose zwei Mol Lactat, während heterofermentative Arten, wie Leuconostoc mesenteroides und Lactobacillus brevis, neben einem Mol Lactat pro Mol Glucose auch Essigsäure und Ethanol produzieren.[11]
Synthetische Herstellung
Synthetisch wird Milchsäure durch Wasseranlagerung an Cyanwasserstoff (Blausäure, HCN) hergestellt. Großtechnisch spielt dabei nur die Synthese von Milchsäure aus Acetaldehyd mit Cyanwasserstoff über Lactonitril eine gewisse Rolle. Letzteres wird über den Einsatz von Salzsäure hydrolysiert, wobei neben der Milchsäure Ammoniumchlorid entsteht. Dieser Syntheseweg wird von dem japanischen Unternehmen Musashino als letztem Großproduzenten für synthetische Milchsäure realisiert.[7]
Verwendung
Ernährung, Futter- und Genussmittel
Eine Reihe von Lebensmitteln werden direkt durch Milchsäuregärung hergestellt. Darunter fallen vor allem die Sauermilchprodukte wie Sauermilch, Joghurt, Kefir und Buttermilch. Diese werden durch Infektion von pasteurisierter Milch mit Starterkulturen der Milchsäurebakterien hergestellt. Weitere Produkte sind lactofermentierte Gemüse wie Sauerkraut, rote Bete in einigen Borschtsch-Varianten oder Gimchi sowie Sauerteig und entsprechend Sauerteigprodukte. Auch Silagen, durch Vergärung haltbar gemachte Frischfuttermittel, basieren auf der Milchsäuregärung.[11]
Als Lebensmittelzusatzstoff trägt Milchsäure die Bezeichnung E 270. Sie wird in der Lebens- und Genussmittelindustrie vielfältig als Säuerungsmittel eingesetzt, so etwa in Backwaren, Süßwaren und vereinzelt in Limonaden. Durch die Änderung des pH-Wertes in den Lebensmitteln auf einen pH von etwa 4 kommt es zu einer Konservierung der Lebensmittel, da eine Besiedlung mit anderen Mikroorganismen weitgehend ausgeschlossen wird.[11]
In Form der Salze Calciumlactat oder Calciumlactatgluconat kann sie zudem zur Calciumanreicherung zugesetzt werden.
Stoffliche Nutzung
Milchsäure ist das Monomer der Polylactide bzw. Polymilchsäuren (PLA), die als biologisch abbaubare Biokunststoffe vielfältige Verwendung finden.
Milchsäure wirkt antibakteriell und wird deshalb Flüssigseifen, Reinigern und Geschirrspülmitteln zugegeben. Die Desinfektionswirkung entfaltet sie optimal bei einem pH-Wert von 3 bis 4.[13] Sie wurde und wird auch als Mittel zur Schwangerschaftsverhütung eingesetzt.[14][15]
Milchsäure wird als Kalklöser in der Gerberei zum Entkalken von Häuten verwendet. Auch in der Textilindustrie und der Druckerei wird sie hierzu eingesetzt.
Imker nutzen Milchsäure zur Behandlung von Bienen gegen die Varroamilbe.[16] Arachnologen verwenden Milchsäure, um die präparierte Epigyne von Spinnenweibchen oder andere Chitinstrukturen aufzuhellen und um Gewebereste aufzulösen.
Die Pharmazeutische Technologie nutzt Milchsäure, um wasserunlösliche Arzneistoffe in Salze der Milchsäure (Lactate) umzuwandeln; diese sind besser wasserlöslich (Beispiel: Ciprofloxacin).[17]
In der Kosmetik wird Milchsäure in Hautcremes und anderen Produkten zur Behandlung von Akne genutzt.
Physiologie
Bei starker Betätigung der Skelettmuskulatur kann es zum Anstieg des Blut-Lactatgehaltes von 5 mg/dl auf 100 mg/dl kommen. Die Ursache ist, dass bei anaeroben Bedingungen, wie beispielsweise bei schneller Betätigung der Skelettmuskulatur, Energie in Form von NAD+ aus der Reduktion von Pyruvat mittels der Lactatdehydrogenase für die Fortführung der Glykolyse gewonnen werden muss. Die dabei anfallende Milchsäure (Lactat und H+) wird über den Monocarboxylat-Transporter 1 aus den Zellen geschwemmt. Dieser Vorgang wurde früher als Ursache des Muskelkaters verstanden, jedoch wird diese Theorie heute größtenteils als falsch betrachtet.
Für den Menschen ist die rechtsdrehende L-(+)-Milchsäure die physiologische. Oral eingenommen wird sie im Organismus schneller abgebaut als die linksdrehende D-(−)-Milchsäure.[18]
Weblinks
- Einschütz, Kathrin: Wirksamkeitsprüfung verschiedener Verfahren zur Verminderung der Keimbelastung auf Handgeräten der Fleischgewinnung. Dissertation, FU Berlin, 2004 urn:nbn:de:kobv:188-2004002043 (Antibakterielle und konservierende Eigenschaften der Milchsäure)
- 3D-Darstellung beider Milchsäuremoleküle zum Vergleich (L- und D-Milchsäure)
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Eintrag zu Milchsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Dez. 2007 (JavaScript erforderlich).
- ↑ 2,0 2,1 2,2 2,3 2,4 Milchsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. März 2011.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-318.
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Gemischen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Eintrag zu Lactic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ Wim Soetart, Erick J. Vandamme (Hrsg.): The Scope and Impact of Industrial Biotechnology. In: Industrial Biotechnology. Sustainable Growth and Economic Success. Wiley-VCH, Weinheim 2010, Seite 9, ISBN 978-3-527-31442-3 (englisch).
- ↑ 7,0 7,1 7,2 7,3 Surinder P. Chahal, John N. Starr: Lactic Acids. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a15_097.pub2.
- ↑ Hans G. Schlegel, Allgemeine Mikrobiologie, 8. Auflage, Thieme 2008.
- ↑ Hans-Josef Endres, Andrea Siebert-Raths: Technische Biopolymere. Hanser-Verlag, München 2009; Seite 103. ISBN 978-3-446-41683-3.
- ↑ J. Crosby: Chirality in Industry – An Overview. In: A. N. Collins, G. N. Sheldrake und J. Crosby (Hrsg.): Chirality in Industry. Wiley, Heidelberg 1992; S. 10. ISBN 0-471-93595-6.
- ↑ 11,0 11,1 11,2 11,3 Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik. 2. Aufl. Wiley-VCH, Weinheim 2006; S.12-13. ISBN 978-3-527-31310-5.
- ↑ Christoph Syldatk: Organische Säuren. Essigsäure (Acetat). In: Garabed Antranikian: Angewandte Mikrobiologie. Springer -Verlag Berlin und Heidelberg 2006; S. 344-347. ISBN 978-3-540-24083-9.
- ↑ Einschütz, Kathrin: Wirksamkeitsprüfung verschiedener Verfahren zur Verminderung der Keimbelastung auf Handgeräten der Fleischgewinnung. Dissertation, FU Berlin, 2004 urn:nbn:de:kobv:188-2004002043.
- ↑ Magnus Hirschfeld, Geschlechtskunde, Band 2, Seite 454f., 1930.
- ↑ zyklusshop.de: Contragel grün, abgerufen am 30. Mai 2013.
- ↑ Serumwerk Bernburg AG, Gebrauchsinformation Milchsäure 15 % ad us. vet., Stand: 14. Januar 2009.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9, S. 482-484; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ Dieter Thierbach: Rätsel des Alltags – Was ist rechtsdrehende Milchsäure?
| Dieser Artikel basiert ursprünglich auf dem Artikel Milchsäure aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |