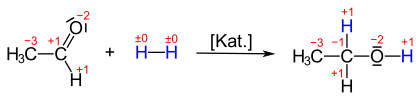| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Reduktion (Chemie)
Eine Reduktion ist eine chemische Teilreaktion, bei der Elektronen von einem Teilchen (Atom, Ion oder einem Molekül) aufgenommen werden.[1] Die Oxidationszahl des Teilchens wird dabei kleiner. Sie tritt immer zusammen mit einer Oxidation auf. Beide Phänomene zusammen werden als Redoxreaktion bezeichnet.
Geschichte
Historisch wurde die Reduktion als ein Entzug von Sauerstoff aus einem Oxid betrachtet. Reduktion (von lat. reductio für „Zurückführung“)[2][3] war damit eine Reaktion, bei der eine Oxidation rückgängig gemacht wurde. Oxidation wurde als Vereinigung einer Verbindung oder eines Elements mit Sauerstoff definiert und beruhte auf den Erkenntnissen von Antoine Laurent de Lavoisier.
Oxide edler Metalle, wie Silber(I)-oxid, zerfallen beim bloßen Erhitzen. Aus Silber(I)-oxid bildet sich Sauerstoff und elementares Silber.
Wird Kupfer(II)-oxid im Wasserstoffstrom erhitzt, so entsteht metallisches Kupfer und Wasser. Wasserstoff wirkt hier als Reduktionsmittel und entzieht dem Kupfer(II)-oxid Sauerstoff.
Heute gilt eine breitere Sichtweise, die nicht auf Reaktionen von sauerstoffhaltigen Verbindungen begrenzt ist und die klassische Betrachtung integriert hat.
Allgemeine Definition
Reduktion ist eine Reaktion bei der ein ein- oder mehratomiges Teilchen Ox ein oder mehrere Elektronen aufnimmt. Dabei bildet sich das Teilchen Red:[4]
Ox reagiert als Elektronenakzeptor, Ox und Red bilden ein sogenanntes Redox-Paar. Die Elektronen stammen von einem zweiten Redox-Paar bei dem eine Oxidation erfolgt. Während im Bereich der Elektrochemie, wie bei einer Elektrolyse oder einer Galvanischen Zelle, der Elektronentransfer zwischen den zwei Redox-Paaren eine messbare Größe ist, lässt sich in anderen Fällen die Reduktion nur über die damit verbundene Erniedrigung der Oxidationszahl von Ox erkennen.
Betrachtet man eine Reduktion als Gleichgewichtsreaktion, ist die Rückreaktion eine Oxidation. Solche Gleichgewichte liegen beispielsweise in einem nicht genutzten Akkumulator vor. Während beim Entladen die Teilreaktion in die eine Richtung verläuft, führt das Laden zu einer Umkehrung der Reaktionsrichtung.
Obwohl eine Reduktion nie ohne Oxidation erfolgt und daher eine Redoxreaktion vorliegt, wird oft eine Reaktion aus der Perspektive des gewünschten Produkts betrachtet. So wird von Reduktion von Eisenerz zum elementaren Eisen oder einer kathodischen Reduktion von Aluminiumoxid zu Aluminium gesprochen.
Aufnahme von Elektronen - Verringerung der Oxidationszahl
Wird ein Eisennagel in eine wässrige Kupfer(II)-sulfatlösung gestellt, bildet sich ein rotbrauner Belag von metallischem Kupfer auf dem Nagel. Das Kupfer wird dabei reduziert, das Eisen zu Fe2+-Ionen oxidiert.
Das Eisen, das während der Redoxreaktion selbst oxidiert wird, nennt man in diesem Zusammenhang auch Reduktionsmittel, weil seine Anwesenheit die Reduktion des Kupfers erst ermöglicht. Reduktion bedeutet dabei immer ein Absinken der Oxidationszahl durch Aufnahme von Elektronen. Oxidation bedeutet dagegen die Abgabe von Elektronen und somit eine Erhöhung der Oxidationszahl. In diesem Fall entsprechen die Ladungen der Teilchen ihrer Oxidationszahl.
Die thermische Zersetzung von Silber(I)-oxid mit den Oxidationsstufen ist auch eine Reaktion, bei der Elektronen übertragen werden.
Bei der Umsetzung von Kupferoxid mit Wasserstoff wird Kupfer reduziert. Als Reduktionsmittel agiert hier Wasserstoff. Die Oxidationsstufe der Sauerstoffatome bleibt in der Reaktion unverändert, die Atome wechseln jedoch ihren Bindungspartner. Die formal entstehenden H+-Ionen kombinieren mit den formal unverändert vorhandenen O2−-Ionen zum Reaktionsprodukt Wasser mit den Oxidationsstufen .
Addition von Wasserstoff
Eine Aufnahme von Wasserstoff durch organische Verbindungen führt zu einer Verringerung der Oxidationszahl eines oder mehrerer Kohlenstoffatome.[5] Die katalytischen Hydrierung von 2-Buten führt zu n-Butan:
Die Oxidationszahlen der ehemals durch Doppelbindung verknüpfte Kohlenstoffatome ändern sich von −1 auf −2. Formal haben diese Atome je ein Elektron und je ein Proton aufgenommen. Das 2. Redox-Paar mit dem Reduktionsmittel H2 kann so formuliert werden:[6]
In dieser Reaktion wird Wasserstoff formal oxidiert und die Elektronen formal freigesetzt. Die Gesamtreaktion ist eine Redoxreaktion, aus der Perspektive des Edukts 2-Buten erfolgt eine Reduktion der Verbindung zu n-Butan. Oft wird diese Reaktion als Additionsreaktion betrachtet. Aus diesem Blickwinkel sind die Änderungen von Oxidationsstufen irrelevant.
Häufiger wird im Zusammenhang mit sauerstoffhaltigen, organischen Verbindungen von Reduktion gesprochen, wie beispielsweise der Umsetzung von Ketonen oder Aldehyden zu Alkoholen. Nimmt Acetaldehyd Wasserstoff auf, so entsteht Ethanol. Dabei ändert sich die Oxidationsstufe der Carbonylgruppe von +1 nach −1:
Reduktionen sind in der Biochemie wichtig. In vielen Stoffwechselwegen einer Zelle findet eine Reduktion durch Übertragung von Wasserstoff statt. Coenzyme wie NADH, NADPH oder FADH sind befähigt, formal ein Hydridion oder Wasserstoff auf eine andere Verbindung zu übertragen.
Einzelnachweise
- ↑ Eintrag: reduction. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.R05222 (Version: 2.3.1).
- ↑ Duden, Deutsches Universalwörterbuch, 4. Aufl., Mannheim, 2001; siehe auch Duden online
- ↑ PONS Online Deutsch - Latein
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin, 2007, S. 218ff.
- ↑ Paula Yurkanis Bruice: Organische Chemie, Pearson Studium, München, 5. Auflage, 2011, S. 823ff.
- ↑ Rückreaktion nach dem 3. Kriterium der Definition einer Oxidation, siehe Eintrag: oxidation. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.O04362 (Version: 2.3.1).
| Dieser Artikel basiert ursprünglich auf dem Artikel Reduktion (Chemie) aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |
![{\displaystyle \mathrm {2\ Ag_{2}O\ {\xrightarrow[{}]{\Delta }}\ 4\ Ag\ +\ O_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/92b1a2d90a7393866541de09f446b2b0678982bd)
![{\displaystyle \mathrm {CuO\ +\ H_{2}\ {\xrightarrow[{}]{\Delta }}\ Cu\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6080949767d7c06542708d1222f2e9f2b46fa78)


![{\displaystyle \mathrm {\ {\xrightarrow[{}]{Reduktion}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cbe51c4c320c6601a67b9a9bcd8d76d527245ba)

![{\displaystyle \mathrm {\ {\xleftarrow[{Oxidation}]{}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4048ca773f2df6398d9db2dfb0ff737cff823884)