| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Natriumfluorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
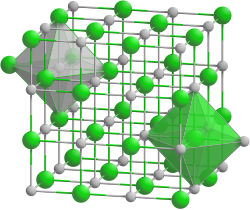
| ||||||||||
| _ Na+ _ F− | ||||||||||
| Kristallsystem |
kubisch | |||||||||
| Raumgruppe |
Fm3m (Nr. 225) | |||||||||
| Koordinationszahlen |
Na[6], F[6] | |||||||||
| Allgemeines | ||||||||||
| Name | Natriumfluorid | |||||||||
| Andere Namen | ||||||||||
| Verhältnisformel | NaF | |||||||||
| CAS-Nummer | 7681-49-4 | |||||||||
| PubChem | 5235 | |||||||||
| ATC-Code | ||||||||||
| DrugBank | DB09325 | |||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 41,99 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,78 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1704 °C[2] | |||||||||
| Löslichkeit | ||||||||||
| Brechungsindex |
1,3252[5] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
1 mg·m−3[2] | |||||||||
| Toxikologische Daten | ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−575 kJ/mol[7] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Natriumfluorid ist ein Natriumsalz der Fluorwasserstoffsäure (Flusssäure).
Vorkommen
Natriumfluorid kommt in der Natur nur in der Form des seltenen Minerals Villiaumit vor.
Gewinnung und Darstellung
Neutralisation von konzentrierter Fluorwasserstoffsäure mit Natronlauge[9]
Überschüssiger Fluorwasserstoff führt zur Bildung von Natriumhydrogenfluorid:
Umsetzung von Fluorwasserstoffsäure mit Natriumcarbonat:
Ausgehend vom Natriumsalz der Hexafluorokieselsäure kann Natriumfluorid durch thermische Zersetzung gewonnen werden.
Eigenschaften
Das farblose Natriumfluorid kristallisiert in der Natriumchloridstruktur und lässt sich zu Einkristallen „züchten“. Es ist durchlässig für Infrarot- und UV-Licht. In Wasser ist es bei allen Temperaturen nur mäßig löslich. Erwärmen steigert die Löslichkeit kaum. In Ethanol löst es sich nicht. In konzentrierter Schwefelsäure setzt es sich zu Natriumsulfat und Fluorwasserstoff um. Infolge teilweise stattfindender Hydrolyse reagiert die wässrige Lösung von Natriumfluorid leicht alkalisch. Natriumfluorid wirkt als Insektizid und ist giftig.
Natriumfluorid bildet mit Natriumchlorid, Natriumcarbonat und Calciumfluorid Schmelzen mit einem Eutektikum, mit Natriumsulfat Schmelzen mit zwei Eutektika. Flüssiges Natriumfluorid leitet den elektrischen Strom, wobei der Widerstand mit steigender Temperatur abnimmt.
Reaktionsverhalten
Natriumfluorid und Schwefelsäure reagieren zu Natriumsulfat und Fluorwasserstoff.
Die hohe Toxizität von NaF im Vergleich zu anderen Natriumhalogeniden (z. B. Natriumchlorid) ist in der Wirkung des Fluoridanions als starke Lewis-Base begründet. Das Fluorid bindet an alle eisenhaltigen Enzyme und blockiert sie somit.
Die Fluoridionen blockieren den Calcium- und Magnesiumstoffwechsel und hemmen wichtige Enzyme. Dies führt zu akut bedrohlichen Stoffwechselstörungen, die unter multiplem Organversagen tödlich verlaufen können.
Verwendung

Natriumfluorid wird als Holzschutzmittel und zum Konservieren von Klebstoffen verwendet. Bei der elektrolytischen Gewinnung von Aluminium dient es als Flussmittel, in der Metallurgie als Schlackenzusatz für Metallschmelzen.
Weitere Anwendungen:
- Fluoridierung von Trinkwasser, Speisesalz, Zahncreme[10] usw., Fluortabletten[11]
- Als Enzymgift bei der Blutentnahme in sogenannten Lactat-Plasma-Blutentnahmeröhrchen für Glucose- und Lactatbestimmung im Blut[12]
- Fluorierungsmittel in der Organischen Chemie.
- Trübungs- und Flussmittel in der Glasherstellung
- Zur Reinigung anderer Fluoride durch Bindung von überschüssigem Fluorwasserstoff
- Einkristalle dienen in der Instrumentellen Analytik als Filter, Linsen und Prismen
- In der Photometrie als Maskierungsmittel für Eisenionen
- Reinigung von Uranhexafluorid bei der Wiederaufarbeitung
- Als Phosphataseinhibitor in der Molekularbiologie
- Mit dem Zyklotronprodukt Fluor-18 als Radiopharmakon für die Skelettszintigraphie mittels Positronen-Emissions-Tomographie (oder in den 1970er Jahren auch mittels rektilinearem Scanner und Ultra-Hochenergiekollimator).
Vorsichtsmaßnahmen
Natriumfluorid ist giftig. Das Einatmen von Stäuben ist zu vermeiden. Bei der Arbeit mit Natriumfluorid sind Handschuhe zu tragen. Als letal wird grundsätzlich eine Menge von 5–10 g für einen 70 kg schweren Menschen angesehen.[10] Allerdings wurden Todesfälle bereits ab einer Dosis von 15 mg/kg beobachtet, was bei einem 70 kg schweren Menschen einer Menge an Natriumfluorid von 1,05 g entspricht.[10] Aus diesen Gründen wird bereits eine Menge von 5 mg/kg als kritische Schwelle angesehen, da bereits ab diesem Punkt ernste lebensbedrohliche Vergiftungserscheinungen auftreten können, die eine sofortige Notbehandlung erfordern.[10]
Einzelnachweise
- ↑ Eintrag zu SODIUM FLUORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am {{{Datum}}}.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Eintrag zu Natriumfluorid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Vorlage:CanJChem
- ↑ Natriumfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am {{{Datum}}}.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, S. 10-247.
- ↑ 6,0 6,1 6,2 B. Martel, K. Cassidy: Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann, 2004, ISBN 1-903-99665-1, S. 363.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1170 ([1] in der Google Buchsuche).
- ↑ Eintrag zu Sodium fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 235–236.
- ↑ 10,0 10,1 10,2 10,3 Fluorverbindungen in Mundhygieneprodukten (PDF; 332 kB)
- ↑ Vgl. auch Karl Joachim Münzenberg, Karlfried Karzel: Die Natriumfluoridtherapie der Osteoporose. 1982.
- ↑ Zusatzstoffe verschiedener Blutentnahmeröhrchen (englisch). (Memento vom 23. September 2015 im Internet Archive)
Weblinks
| Dieser Artikel basiert ursprünglich auf dem Artikel Natriumfluorid aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |