| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Amphetamin
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||
| 1:1-Gemisch der Stereoisomeren (R)-Amphetamin (links) und (S)-Amphetamin (rechts) | |||||||||||||||
| Allgemeines | |||||||||||||||
| Freiname | Amfetamin | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C9H13N | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| PubChem | 3007 | ||||||||||||||
| ATC-Code | |||||||||||||||
| DrugBank | DB00182 | ||||||||||||||
| Kurzbeschreibung |
amin-artig riechende, scharf schmeckende Flüssigkeit[1] | ||||||||||||||
| Arzneistoffangaben | |||||||||||||||
| Wirkstoffklasse |
indirektes Sympathomimetikum | ||||||||||||||
| Wirkmechanismus |
Noradrenalin/Dopamin-Freisetzung | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 135,21 g·mol−1 | ||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||
| Dichte |
0,93 g·cm−3[1] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt |
200–203 °C[1] | ||||||||||||||
| Dampfdruck | |||||||||||||||
| pKs-Wert |
10,13[3] | ||||||||||||||
| Löslichkeit |
| ||||||||||||||
| Brechungsindex |
1,518 (26 °C)[4] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Toxikologische Daten | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||
Amphetamin (alpha-Methylphenethylamin), auch Phenylisopropylamin oder Amfetamin genannt, ist eine vollsynthetisch hergestellte Substanz aus der Stoffgruppe der Amphetamine. Sie findet derzeit in der Pharmazie als Arzneistoff zur Behandlung der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) sowie Narkolepsie Verwendung. Amphetamin wirkt stark stimulierend bzw. aufputschend, wie alle Amphetamine und die meisten Stimulanzien appetitzügelnd und euphorisierend und ist insbesondere in der Drogenszene unter Bezeichnungen wie Speed oder Pep(p) weit verbreitet.
Amphetamin ist die Stammverbindung der Substanzklasse Amphetamine, der etliche weitere psychotrope Substanzen angehören, unter anderem Methamphetamin und das in der Natur vorkommende Ephedrin. Es ist ein Stimulans und indirektes Sympathomimetikum, d. h., es regt die sympathischen Teile des vegetativen Nervensystems an.
Da Amphetamin in der Bundesrepublik Deutschland aufgrund seiner Aufführung in der Anlage III im Betäubungsmittelgesetz ein verkehrsfähiges und verschreibungsfähiges Betäubungsmittel darstellt, wird der Handel und Besitz ohne Erlaubnis strafrechtlich verfolgt.
Überblick
Die Erstsynthese des Amphetamins gelang 1887 dem rumänischen Chemiker Lazăr Edeleanu an der Humboldt-Universität zu Berlin.[8] 1927 prägte der US-amerikanische Chemiker Gordon Alles den Namen Amphetamin, sich ableitend aus der heute veralteten chemischen Bezeichnung alpha-Methylphenethylamin. Es zählt zu den Weckaminen (Amine mit „aufweckender“ Wirkung).
Ursprünglich als Bronchospasmolytikum und zur Gewichtskontrolle verwendet, wird es heute aufgrund des Suchtpotenzials sowie anderer Nebenwirkungen medizinisch nur noch zur Behandlung der Narkolepsie und der Aufmerksamkeitsdefizit-/
Als Rauschmittel ist Amphetamin aufgrund seiner Wirkungen wie Unterdrückung von Müdigkeit und der Steigerung des Selbstbewusstseins vor allem in der Partyszene verbreitet. Es wird auch als Dopingmittel gebraucht. Die Menge an beschlagnahmtem Amphetamin in der Europäischen Union nimmt seit 1985 mehr oder weniger ständig zu; während ab 1999 eine gewisse Stagnation erreicht wurde, stieg die Zahl in den skandinavischen Ländern weiter an.[9][10]
Entwicklung und Verbreitung
Vor 1900 bis 1950
- 1887: Lazăr Edeleanu synthetisierte im Zuge seiner Doktorarbeit[8] als Erster[11] das Amphetamin.
- 1893 Der japanische Chemiker Nagayoshi Nagai synthetisiert das Amphetaminderivat Methamphetamin.[12]
- 1910 entdeckten die englischen Physiologen Barger und Dale die Ähnlichkeit der chemischen Struktur des Amphetamins mit dem Adrenalin.[13]
- 1927 wurde von Gordon Alles der Begriff Amphetamin geprägt, welcher nach einem günstigeren und einfacher zu synthetisierendem Ersatz für das natürlich vorkommende Ephedrin (aus Meerträubel/Ephedra) suchte.[13]
- 1932 brachte Smith, Kline & French in den Vereinigten Staaten Amphetaminsulfat unter dem Namen „Benzedrine“ als Inhalator zur Weitung der Bronchien auf den Markt (Bronchospasmolytikum, Anwendung bei Atemwegserkrankungen wie Asthma). In Deutschland wurde das Mittel als „Benzedrin“ vertrieben.
- 1935 Die stimulierende Wirkung wurde erkannt und zur Behandlung von Narkolepsie medizinisch genutzt.[14]
- 1937 vergab der Psychiater Charles Bradley in einer Studie Benzedrin an verhaltensauffällige Kinder, deren Störungen sich daraufhin besserten.[15] Er wiederholte die Studie im Jahr 1941. Bradleys Studien gelten als grundlegend für die Psychopharmakotherapie von Kindern.[16]
- 1938: Die Berliner Temmler-Werke brachten unter dem Markennamen „Pervitin“ Methamphetamin auf den Markt (bis 1988 hergestellt).
- Bis Ende der 1930er Jahre erlangte Amphetamin Verbreitung als Appetithemmer, gegen Erkältungen und für Indikationen wie Narkolepsie, Depressionen, Schwangerschaftserbrechen, Kater (Alkoholintoxikation) und andere. Mit der Zahl der Indikationen stieg die Zahl der Verschreibungen rasch an.[11] Zu dieser Zeit gab es schon Kombipräparate (z. B. „Dexamyl“), die neben Amphetamin ein starkes Beruhigungsmittel (meistens verschiedene Barbiturate) gegen dessen Nebenwirkungen enthielten, eine Kombination, die heute als wenig sinnvoll und riskant angesehen wird.
- Im Zweiten Weltkrieg wurden Amphetaminderivate in den Armeen Deutschlands (Methamphetamin „Pervitin“), der Vereinigten Staaten („Benzedrin“), Großbritanniens und Japans eingesetzt, um Soldaten wach, motiviert und aggressiv zu halten.[11]
- 1941 wurde es in Deutschland aufgrund sich häufenden Missbrauchs und Suchtfällen dem Reichsopiumgesetz unterstellt, wodurch der Verkehr mit dem Stoff reglementiert wurde.
- 1948 brachte Glaxo-Wellcome in den USA Dexedrine (bis zu 15 mg Dexamphetamin je Kapsel) als Mittel gegen ADHS auf den Markt.
1950 bis heute
- in den 1950er Jahren erreichten der Gebrauch und Missbrauch von Stimulanzien in Japan enorme Ausmaße, 1954 gab es 550.000 chronische Nutzer und zwei Millionen ehemalige Konsumenten.[17] In Europa (dort vor allem in Schweden) und den USA nimmt der Stimulanzienmissbrauch ebenfalls zu.
- 1959 gab es erste Berichte über Konsumenten in den USA, die den Inhalt der Benzedrine-Inhalatoren mit Spritzen injizieren, im Zuge dessen wurden zur Injektion missbrauchbare Inhalatoren vom Markt genommen. Erste Fälle von illegal produziertem Amphetamin wurden bekannt.
- 1970: Amphetamin wird in den Vereinigten Staaten in Schedule II des Controlled Substances Act aufgenommen, somit wurden Handel, Besitz und Herstellung ohne Genehmigung strafbar; durch einen Arzt ist es weiterhin verschreibungsfähig.
- im 1981 neugefassten Betäubungsmittelgesetz (BtMG) wurde Amphetamin in Anlage III aufgeführt, was Handel, Besitz und Herstellung ohne Genehmigung unter Strafe stellt; von Ärzten konnte es allerdings nach wie vor verschrieben werden. Zuvor war Amphetamin in Deutschland ohne spezielle Auflagen verschreibbar. Heute (Stand: März 2014) sind das Amphetamin-Racemat und Dexamphetamin weiterhin verkehrs- und verschreibungsfähig, siehe Rechtsstatus.
- 1996 wird in den Vereinigten Staaten Adderall (bis zu 30 mg Amphetamin je Tablette) als Mittel zur ADHS-Behandlung zugelassen.[18]
- Im Militär verschiedener Länder wird Amphetamin vermutlich bis heute zur Leistungssteigerung eingesetzt.
Klinische Angaben
Anwendungsgebiete (Indikationen)
Amphetamin und Dexamphetamin werden in Deutschland zur Behandlung der Aufmerksamkeitsdefizit-/
Amphetamin findet in den Vereinigten Staaten (USA) wieder vermehrt Verbreitung für die medikamentöse Behandlung der ADHS, die Verschreibungszahlen stiegen in den 1990er Jahren von weniger als 1 Million Verschreibungen auf fast 6 Millionen an.[19] Laut einer Studie von 2001 im Auftrag des US-amerikanischen Kongresses gibt es in den USA keine Erkenntnisse über eine Häufung von Missbrauchsfällen unter Schülern.[20]
Amphetamin kam früher auch als Asthmamittel zum Einsatz, da es zum Abschwellen der Schleimhäute führt und vor allem die Weitung der Bronchien ein freieres Atmen ermöglicht. Neben weiteren Anwendungen wurde es unter Anderem auch als Appetitzügler und als Antidepressivum genutzt.
Wechselwirkungen mit Arzneimitteln
Mit folgenden Medikamenten (unvollständige Aufzählung) sind teilweise lebensgefährliche Arzneimittelwechselwirkungen bekannt: Chlorpromazin, Fluoxetin, Fluphenazin, Fluvoxamin, Guanethidin, Isocarboxazid, Mesoridazin, Methotrimeprazin, Paroxetin, Perphenazin, Phenelzin, Prochlorperazin, Promethazin, Propericiazin, Rasagilin, Thioridazin und Trifluoperazin. Wechselwirkungen umfassen psychotische Symptome, Gefahr einer hypertensiven Krise und mögliches Auftreten eines Serotonin-Syndroms.[21] Bei gleichzeitigem Gebrauch von Monoaminooxidase-Hemmern kann der Abbau von Amphetamin gehemmt werden, was ebenso lebensgefährliche Wechselwirkungen hervorruft.[22]
Wirkungen und Nebenwirkungen
Amphetamin ist ein zentrales Sympathomimetikum und wirkt im Gehirn und Rückenmark stimulierend auf den Sympathikus, einen Teil des vegetativen Nervensystems. Durch eine hinreichend hohe Dosis Amphetamin wird der Organismus in einen ergotropen Zustand versetzt, ein Stresszustand, der es ermöglicht, alle Notfallfunktionen des Organismus für eine erhöhte Handlungsbereitschaft zu aktivieren, was in lebensbedrohlichen Situationen sinnvoll ist.
Je nach Dosis und Darreichungsform können nach der Einnahme von Amphetamin folgende Wirkungen auftreten:[22][23][24]
- erhöhte Wachheit, weniger Müdigkeit, verringertes Schlafbedürfnis, Schlafstörungen und Nervosität
- erhöhte Aufmerksamkeit und Konzentrationsfähigkeit, unwillentliche Fokussierung bis hin zum Tunnelblick
- Verminderung bis Unterdrückung von Hunger und Durst
- erhöhte Herzfrequenz bis hin zur Tachykardie (Herzrasen)
- Kammerflimmern
- Hypertonie
- zerebraler Krampfanfall
- (Zentrales) Anticholinerges Syndrom
- Verengung der Blutgefäße, erhöhter Blutdruck
- Weitung der Bronchien und Abschwellen der Schleimhäute, Mundtrockenheit
- Steigerung des Selbstbewusstseins bis hin zur Euphorie
- erhöhte Risikobereitschaft, verringerte Aggressionsschwelle
- vermindertes Schmerzempfinden
- Agitation (fahrige Bewegungsabläufe), erhöhter Bewegungsdrang, Unruhe und Symptome des Restless-Legs-Syndroms
- Tremor (Zittern), erhöhter Muskeltonus (Verspannungen), Nystagmus (Augenzittern) und Bruxismus (Zähneknirschen)
- Symptome der Hyperhidrose (erhöhte Schweißabsonderung)
- gesteigertes sexuelles Verlangen
- Weitung der Pupillen
- Harnverhalt (Unvermögen, trotz Harndrangs die Blase zu entleeren)
- Logorrhoe (gesteigertes Mitteilungsbedürfnis)
Durch chronischen Konsum können zusätzlich folgende Wirkungen eintreten:
Pharmakologie
Pharmakodynamik
Die Wirkung des Amphetamins auf das ZNS besteht hauptsächlich in der Ausschüttung der Neurotransmitter Noradrenalin (NA) und Dopamin (DA) – das Verhältnis beträgt dabei 3,5:1 (NA:DA). Eine wesentliche Ausschüttung von Serotonin (5-HT) wird dagegen nicht beobachtet.[25]
Der Freisetzungs-Mechanismus umfasst drei Schritte:
- den Einstrom des Amphetamins in die präsynaptische Zelle über den Transporter
- die Freisetzung der Neurotransmitter aus den Vesikeln (Speicherbläschen innerhalb der Zelle) in den Zellinnenraum (Zytosol)
- den aktiven Transport der Transmitter vom Zellinneren in den außerzellulären Raum (synaptischer Spalt) mittels einer Richtungsumkehrung des zellmembranständigen Transporters (Inversion).[26]
Auf diese Weise wird der extrazelluläre Transmitterspiegel erhöht. Im Gegensatz zum Prinzip der Wiederaufnahmehemmung geschieht dies unabhängig vom Signalimpuls der Nervenzelle.
Die wiederholte Einnahme (in rascher Folge) von Amphetamin führt zu einer kurzfristigen Toleranzentwicklung durch Tachyphylaxie. Die Speichervesikel in den Neuronen erschöpfen sich nach mehrmaliger Stimulation, sodass nach Eintritt der Tachyphylaxie kein Noradrenalin und Dopamin mehr zur Ausschüttung zur Verfügung stehen. Die Tachyphylaxie endet erst einige Stunden später, wenn sich die Speichervesikel wieder mit den Neurotransmittern aufgefüllt haben.
Pharmakokinetik
Die Plasmahalbwertszeit des Dextroamphetamins beträgt ungefähr zehn Stunden, somit dauert es knapp drei Tage, bis die Menge im Organismus auf ein Prozent der Einnahmemenge gefallen ist. Die Lipidlöslichkeit ist LogP = 1,799, es verteilt sich daher bevorzugt im Fettgewebe. Seine Proteinbindung beträgt zwischen 25 und 40 %, die Metabolisierung findet in der Leber durch das Cytochrom-P450-Isoenzym 2D6 statt.[27]
Die dabei gebildete wasserlösliche Säure wird im Urin ausgeschieden. Die Ausscheidungsmenge ist vom pH-Wert des Urins abhängig, je saurer der Urin (z. B. durch Einnahme von Ascorbinsäure oder sauren Fruchtsäften), umso schneller die Ausscheidung.[28]
Toxikologie
Die letale Dosis beim Menschen liegt bei 1,3 mg/kg (LDLo, niedrigste publizierte letale Dosis); bei 75 kg Körpergewicht entspräche das etwa 100 mg. Bei bestehender Toleranz liegt die Dosis bedeutend höher, so sind Fälle von Einzeldosen von 1000 mg und Tagesdosen von bis zu 5000 mg bekannt. Versuche mit Affen zeigten eine deutliche höhere relative Toxizität bei Jungtieren, die LD50 in mg/kg lag dort etwa 65 % bis 75 % unter der von adulten Tieren.[29]
In Deutschland wurden im Jahr 2010 insgesamt 20 Todesfälle gezählt, die direkt mit dem alleinigen Konsum von Amphetamin in Verbindung standen. In 54 weiteren Todesfällen war Amphetamin neben anderen Drogen auch involviert[30]. Im Jahr 2013 wurden in Deutschland insgesamt 16 Todesfälle im direkten Zusammenhang mit Amphetamin gezählt, in 32 weiteren Fällen war Amphetamin neben anderen Drogen involviert[31]. Bezogen auf das Jahr 2014 veröffentlichte die Drogenbeauftragte der Bundesregierung keine entsprechenden Zahlen.
Neurotoxisches Potenzial
Es gibt keine Hinweise dafür, dass therapeutisch genutzte Amphetamindosen eine schädigende Wirkung auf Gehirnzellen haben. In Tierversuchen zeigten sich durch hohe Dosen parenteral verabreichten Amphetamins Veränderungen an dopaminergen Neuronen in Nucleus caudatus und Putamen (Teile des Striatums). Es ist unbekannt, ob die Langzeitverabreichung von hohen Amphetamindosen ähnliche Veränderungen beim Menschen hervorrufen kann. Die Langzeitverabreichung niedrigerer Dosen zeigte im Tiermodell keine derartigen Veränderungen.[32]
Physikalisch-chemische Eigenschaften und Synthese
Allgemeines
Der offizielle IUPAC-Name ist 1-Phenylpropan-2-amin. Amphetamin hat ein Stereozentrum am Kohlenstoffatom C2 und ist damit chiral. Daher existieren zwei Isomere, das Dextroisomer (Dexamphetamin, D-Amphetamin) und das Levoisomer (Levamphetamin, L-Amphetamin). Die Wirkungen beider Isomere sind ähnlich, Dexamphetamin weist ungefähr die doppelte Wirksamkeit von Levamphetamin als Psychopharmakon auf[33] und gilt daher als Eutomer. Als „Amphetamin“ wird die 1:1-Mischung (Racemat) aus L-Amphetamin und D-Amphetamin bezeichnet. Es ist ein Homologon des Phenylethylamins. Die Amphetaminbase, eine farblose bis sehr schwach gelbliche, ölige Flüssigkeit, ist wenig löslich in Wasser, löslich in Alkoholen, Ether und schwachen Säuren wie Essigsäure. Mit alkoholisch verdünnter Schwefelsäure geht sie eine Reaktion ein und bildet das ausfallende Sulfat-Salz. Die Base hat einen charakteristischen Amingeruch. Bei höherer Konzentration in der Atemluft vermerkt man ein Brennen der Schleimhäute (Augen, Nase).
Industrielle Herstellung (Synthese)
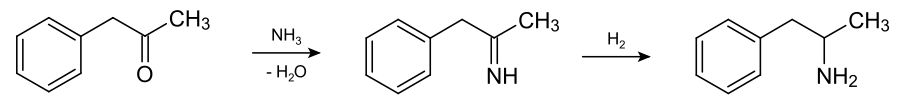
Es existiert eine Vielzahl unterschiedlichster Syntheserouten. In der pharmazeutischen Industrie wird Amphetamin in der Regel durch Kondensation von 1-Phenyl-2-propanon (Phenylaceton/P2P) mit Ammoniak und anschließender Reduktion hergestellt. Dabei entsteht racemisches (RS)-Amphetamin [(RS)-1-Phenylpropan-2-amin], also ein 1:1-Gemisch aus (R)-Amphetamin [(R)-1-Phenylpropan-2-amin] und (S)-Amphetamin [(S)-1-Phenylpropan-2-amin]:
In den USA lag die von der DEA genehmigte Produktionsmenge im Jahr 2000 bei 15.000 kg, entsprechend 500.000.000 Einzeldosen zu 30 mg.[19]
Analytik
Die zuverlässige qualitative und quantitative Analyse von Amphetamin gelingt in den unterschiedlichen Untersuchungsmaterialien wie Blut, Blutserum, Blutplasma,[34] Haaren,[35] Urin[36][37] oder Speichel[38] oder Abwässern[39] nach geeigneter Probenvorbereitung durch die Kopplung chromatographischer Verfahren wie der Gaschromatographie oder HPLC mit der Massenspektrometrie. Auch Enzymimmunoassays sind als Screeningtests verfügbar, sollten jedoch für forensische Zwecke durch die oben genannten spezifischeren Methoden ergänzt werden.[40]
Nichtmedizinischer Gebrauch
Illegale Amphetamine werden als Pulver, Bombe (In Papier eingewickeltes Speed) oder seltener in Pillenform konsumiert.[41] Das Pulver wird meistens durch die Nase aufgenommen, möglich sind aber auch oraler sowie parenteraler und rektaler Konsum.[42] Während die orale Aufnahme bei medizinischer Anwendung die gängige Darreichungsform ist, ist sie ansonsten wenig verbreitet. Das dürfte daran liegen, dass beim oralen Konsum die Wirkung langsamer eintritt und es aufgrund des langsameren Anflutens zu einem weniger plötzlichen Wirkungseintritt (geringerer „Kick“) kommt. Die Wirkung jedoch hält insgesamt länger an. Amphetamin hat oral eine Bioverfügbarkeit von ca. 75 %.
Anders als beim Methamphetamin ist es nicht möglich, Amphetamin zu rauchen, weil das enthaltene Amphetaminsulfat einen so hohen Siedepunkt hat, dass es sich vorher durch Pyrolyse zersetzt.
Die Europäische Beobachtungsstelle für Drogen und Drogensucht berichtet, dass 2009 der übliche Verkaufspreis von Amphetamin in der Hälfte der Berichtsländer in Europa zwischen 5 und 30 Euro pro Gramm liegt.[43] Laut Bundeskriminalamt wurden 2010 in Deutschland rund 1.200 Kilogramm Amphetamin sichergestellt, 33.482 Straftaten (1% aller Straftaten in dem Jahr) standen im Zusammenhang mit Amphetaminderivaten.[44][45]
Amphetamin wird in Deutschland und Europa hauptsächlich in der Techno-Szene konsumiert, um unter anderem länger tanzen zu können. Es wirkt leicht euphorisierend, hält wach und ermöglicht um mehrere Stunden verlängerte Tätigkeiten. Bei nachlassender Wirkung kommt es zu Nervosität und Abgespanntheit („Abturn“); der Körper fordert die dringend benötigte Ruhe ein, aber das noch nicht abgebaute Amphetamin verhindert das. Aus diesem Grund ist es verbreitet, sich durch den Konsum von Cannabis zu beruhigen („herunterrauchen“). Teilweise werden auch starke Beruhigungsmittel aus der Stoffgruppe der Benzodiazepine wie Rohypnol oder Valium eingenommen, um zur Ruhe zu kommen.
Doping
Doping mit Amphetaminen ist seit den 1930er Jahren weit verbreitet. Erst bei den Olympischen Spielen 1972 wurde durch eine computergesteuerte Kontrolle durch Manfred Donike diesem weitgehend ein Riegel vorgeschoben. Da Amphetamin den Körper im Sport zusätzlich aufheizt, eignet es sich besonders bei Wettkämpfen bei feucht-kaltem Wetter.[46] Die Dosierung ist hierbei individuell. Die WADA als internationale Anti-Doping-Agentur gestattet inzwischen Amphetamin im Training und verbietet (und kontrolliert) es nur noch in Wettkämpfen. Der Doping-Fall Jan Ullrichs im Frühjahr 2002, als er in der Rehabilitation Amphetamine zu sich nahm, führte damals zu sechs Monaten Sperre.[47] Nach späteren NADA-/WADA-Codes wäre dies nicht der Fall gewesen, da Amphetamine als soziale Drogen nur noch im Wettkampf verboten sind.[48]
Gesundheitsgefahren
Zu den gesundheitlichen Risiken, die mit dem Konsum von Amphetamin einhergehen, zählen gesteigerte Aggressivität, Krämpfe, Zittern, Kreislaufkollaps, Herzrasen und Herzinfarkt. Bei einem Abhängigkeitssyndrom können Zerfall der Muskulatur, Nierenversagen, Gedächtnisstörungen, Schlaganfall, paranoide Wahnvorstellungen und Depressionen, Bewusstseinstrübung bis hin zu Koma und chronische Psychosen auftreten.[49] Es kann zu einer Vernachlässigung sozialer Verpflichtungen (Familie, Schule, Beruf, Beziehung) kommen. Werden Amphetamine häufig geschnupft, kann es zu einer Schädigung bis zur Auflösung der Nasenscheidewand kommen.
Das Risiko, eine Abhängigkeit zu entwickeln, hängt von genetischen Faktoren sowie von der psychosozialen Situation der Person ab. Im Tiermodell konnten manche Individuen ihren Amphetaminkonsum lebenslang flexibel regulieren, bei 50 % trat dagegen nach einer gewissen Zeit eine Abhängigkeit mit massiver Dosissteigerung und Erwerb einer Toleranz auf, die auch nach erzwungenem Entzug bestehen blieb.[50]
Häufig geraten die Konsumenten in einen Teufelskreis aus abwechselnder Einnahme von aktivierenden und beruhigenden Drogen, wobei jedes Mittel jeweils die Nachwirkungen des anderen mildern soll.
Bei Amphetaminabhängigen kommt es nach dem Absetzen des Amphetamins zu Entzugserscheinungen. Symptome des Amphetaminentzugs sind Lethargie, Depressionen bis hin zum Suizid, taktile Halluzinationen (engl. crank bugs),[51] Apathie, Angst und Schlafstörungen.[52] Möglich sind auch Muskelschmerzen, Bauchschmerzen und übermäßiger Appetit. Den Höhepunkt erreichen die Entzugssymptome nach etwa drei Tagen und ebben dann langsam ab. Im Vergleich mit dem Benzodiazepinentzug ist der Amphetaminentzug körperlich ungefährlich.
Das Risiko zur Entwicklung einer Psychose beträgt bei Amphetaminabhängigen 25 %, im Vergleich zum 25-fach geringeren Erkrankungsrisiko in der Gesamtbevölkerung von 1 %. Zudem treten schwere Affektschwankungen zwischen unangepasster Euphorie und schweren Depressionen durch den Konsum auf.[53][54]
Es gibt Hinweise, dass bei Amphetaminmissbrauch das Risiko, später an Morbus Parkinson zu erkranken, deutlich erhöht ist.[55]
Strecken von Amphetamin
Das weiß-gelbliche/rosa Pulver, das dem Drogenkonsumenten illegal als Speed angeboten wird, besteht nur zu einem Teil aus Amphetamin. Meist sind Coffein oder neutrale Streckmittel wie Glucose oder Milchzucker enthalten, aber auch andere psychoaktive Substanzen wie Paracetamol, Ephedrin oder Methamphetamin können beigemischt sein. Amphetamin wird illegal auch als „Paste“ gehandelt, die oft leicht feucht und klumpig ist und nach Amin riecht (Geruch von Fisch, der zu verwesen beginnt). Die Masse ist meist eine Mischung aus Amphetaminsalz und Lösungsmitteln.
Im Gegensatz zu den Europäischen Staaten kam es in den USA häufiger vor, dass Speed mit Methamphetamin gestreckt war, was eventuell auf die bessere Verfügbarkeit der für die Synthese benötigten Ausgangsstoffe zurückzuführen war (Ephedrinpräparate waren in den USA bis März 2005 rezeptfrei erhältlich).
Da der jeweilige Amphetaminanteil unklar ist, besteht für den Konsumenten stets das Risiko einer Überdosierung sowie der Unverträglichkeit von Streckmitteln (eine tödliche Dosis kann bei einem Menschen mit 75 kg Körpergewicht schon bei etwa 100 mg Amphetamin liegen). Drugchecking hat deshalb eine wichtige Bedeutung zur Risikominderung.
Illegale Synthese
In der illegalen Produktion wird Amphetamin beispielsweise durch Reduktion von Norephedrin (Phenylpropanolamin) mit Iod und rotem Phosphor oder aus Phenylaceton gewonnen. Konnte Amphetamin früher auch von Privatleuten relativ ungehindert aus Vorstufen wie Phenylaceton und Hydroxylamin synthetisiert werden, wurden diese Chemikalien zunehmend von den Behörden beobachtet bzw. bei Phenylaceton und Norephedrin die ungenehmigte Herstellung und der Handel unter Strafe gestellt (Grundstoffüberwachungsgesetz). Dadurch entstand für illegal arbeitende Produzenten ein Bedarf an Ersatzstoffen, die nicht überwacht wurden. So wurde Phenylessigsäure unter anderem nach und nach in die illegale Produktion einbezogen. Seit Jahrzehnten gibt es immer neue Anweisungen für Herstellungsmöglichkeiten von Amphetamin, die Stoffe benutzen, die noch nicht verdächtig sind. Auch auf diese Herstellungswege werden die Behörden schließlich aufmerksam und der Kreislauf setzt sich fort. Sogenannte „OTC-Methoden“ (over the counter, englisch für „Über-die-[Laden-]Theke“, was etwa „frei erhältlich“ bedeutet) verbreiten sich daher zunehmend. Die Bezeichnung steht für die Gewinnung von benötigten Vorläuferstoffen aus rezeptfreien Medikamenten oder anderen frei verfügbaren Waren (Reiniger, Autozubehör), deren Abgabe anders als bei Reinstoffen nicht wirksam reglementierbar ist. So konnte beispielsweise Norephedrin (PPA) in den Vereinigten Staaten bis 2002 aus rezeptfreien Appetithemmern gewonnen werden.
Illegal wird Amphetamin hauptsächlich durch Reduktion von Phenyl-2-nitropropen mit Al(Hg) oder LiAlH4 oder durch reduktive Aminierung von Phenylaceton und Ammoniak + Al(Hg) hergestellt. Als leicht erhältliche Ausgangsstoffe dienen Benzaldehyd und Nitroethan oder die Ester der Phenylessigsäure. Die bei dieser Herstellung anfallenden Chemikalien werden zumeist illegal entsorgt: Lösemittel (Aceton, Ether, Methanol und andere) und Säuren (Schwefelsäure, Salzsäure) werden meist in Behältern nachts in freiem Gelände abgeladen oder in Flüsse entleert, teils (dazu gehören Wasserstoffkartuschen) in Brand gesteckt.[56] Unter anderem in den USA und den Niederlanden – beides Staaten mit hoher illegaler (Meth-)Amphetaminproduktion – wachsen die Umweltschäden durch giftige Nebenprodukte teilweise zu gravierenden Problemen heran. Bei der Herstellung von 1 Kilogramm Amphetamin fallen je nach Syntheseroute 5 bis 20 Liter Abfälle an. Neben der Quantität hängen die Art und die Giftigkeit der Abfälle von der jeweiligen Syntheseroute ab.[56]
Sonstige Informationen
Rechtsstatus
In der Bundesrepublik Deutschland ist Amphetamin im Betäubungsmittelgesetz (BtMG) aufgeführt: das Racemat D,L-Amphetamin sowie das Dextroamphetamin sind als verkehrs- und verschreibungsfähig in Anlage III eingestuft.[57] Das reine Levoisomer Levamphetamin ist in Anlage II als verkehrs-, aber nicht als verschreibungsfähig aufgeführt.[58] Handel und Besitz ohne Rezept oder Genehmigung sind strafbar. In den USA ist Amphetamin erfasst in Schedule II des Controlled Substances Act, was den Besitz und Handel ohne Rezept oder Genehmigung unter Strafe stellt.[59] Es ist dort zugelassen für die Indikationen Narkolepsie und ADHS.
Für einen Patienten dürfen Ärzte in der Bundesrepublik Deutschland innerhalb von 30 Tagen 600 mg Amphetamin oder 600 mg Dexamphetamin verschreiben. In begründeten Einzelfällen und unter Wahrung der erforderlichen Sicherheit des Betäubungsmittelverkehrs darf der Arzt für einen Patienten, der in seiner Dauerbehandlung steht, von dieser Vorschrift hinsichtlich der festgesetzten Höchstmenge abweichen. Eine solche Verschreibung ist mit dem Buchstaben „A“ zu kennzeichnen (geregelt in der Betäubungsmittel-Verschreibungsverordnung, BtMVV).[60] Bis zur Neufassung der BtMVV vom 20. Januar 1998 (in Kraft getreten am 1. Februar 1998) durften Ärzte für einen Patienten an einem Tage bis zu 200 mg Amphetamin (das heißt maximal 6 Gramm pro Monat) verschreiben.[61]
In Österreich gelten Amphetamin, Dexamphetamin und Levamphetamin als Suchtgifte im Sinne des Suchtmittelgesetzes, da sie in der UN-Konvention über psychotrope Substanzen erfasst sind. Alle drei sind nach der Suchtgiftverordnung auf Suchtgiftrezepten verschreibungsfähig, dabei sind keine Höchstmengen festgesetzt.[62]
Seit 1998 lautet in der Bundesrepublik Deutschland die behördliche Schreibweise Amfetamin, sie wurde damit der WHO-Nomenklatur angepasst.[63]
Arzneimittel und Handelsnamen
In Deutschland kann Amphetaminsulfat als Saft zu 2 mg/ml nach NRF 22.4 oder als Kapseln zu 5 oder 10 mg nach NRF 22.5 verschrieben werden. Ferner kann Dexamphetaminsulfat als 2,5 %ige Tropfen nach NRF 22.9 verschrieben werden.[64] In der Schweiz können entsprechende Magistralrezepturen verschrieben oder im Ausland bestellt werden.[65] In Österreich ist allen öffentlichen Apotheken die Abgabe entsprechender Zubereitungen gestattet.[62]
In Deutschland ist seit Dezember 2011 „Attentin“ – welches 5 mg Dexamphetaminhemisulfat enthält – für Kinder und Jugendliche verfügbar.[66]
In den Vereinigten Staaten sind Fertigpräparate unter den Markennamen „Dexedrine“, „ProCentra“, „Zenzedi“ (Wirkstoff Dexamphetamin) und „Adderall“ (enthält als Wirkstoff eine Enantiomerenmischung aus Dexamphetamin und Levamphetamin im Verhältnis 72,7 % zu 27,3 %[67][68]) erhältlich.
Ein Abkömmling des Dexamphetamins, das Lisdexamfetamin (fungiert als Prodrug des Dexamphetamins), ist in den USA unter dem Namen „Vyvanse“, in Deutschland seit Juni 2013 unter dem Namen „Elvanse“ erhältlich.[69]
Literatur
- Walter Reginald Bett u. a.: Amphetamin in der klinischen Medizin. Springer, Berlin 1956.
- Sean Connolly: Amphetamines. Heinemann Library, Chicago 2000, ISBN 1-57572-254-2.
- Hans Cousto: Drogen-Mischkonsum. Das Wichtigste in Kürze zu den gängigsten (Party-)Drogen. Nachtschatten, Solothurn 2003, ISBN 3-03788-119-4.
- Hans-Christian Dany: Speed. Eine Gesellschaft auf Droge. Edition Nautilus, Hamburg 2008, ISBN 978-3-89401-569-5.
- A. K. Cho, David S. Segal: Amphetamine and Its Analogs. Psychopharmacology, Toxicology, and Abuse. Academic Press, San Diego 1994, ISBN 0-12-173375-0.
- Nicolas Rasmussen: On Speed. The Many Lives of Amphetamine. New York University Press, New York 2008, ISBN 978-0-8147-7601-8.
- Stephen Smith: Sucht. Die Geschichte des Stephen Smith. Ullstein, Berlin 1998, ISBN 3-548-31215-2.
- Leslie Iversen: Speed, Ecstasy, Ritalin. Amphetamine – Theorie und Praxis. Verlag Hans Huber, 2006, ISBN 3-456-84519-7.
Weblinks
- drogenkult.net: Informationen zu Amphetamin/Methamphetamin
- suchtzentrum.de: Infos zu Risiken und Wirkung
- Amphetamin und Methylphenidat bei Aufmerksamkeitsstörung
- adderallxr.com: Beipackzettel zu Adderall (Memento vom 19. August 2007 im Internet Archive) (PDF; 113 kB)
- rxlist.com: Klinische Daten, Dosierung und Risiken zu Amphetamin (Memento vom 16. Juni 2008 im Internet Archive)
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Amphetamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Juni 2014.
- ↑ Eintrag zu Amphetamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Dez. 2007 (JavaScript erforderlich)
- ↑ 3,0 3,1 Eintrag zu Amphetamin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-432.
- ↑ 5,0 5,1 Datenblatt DL-Amphetamine sulfate salt bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Gemischen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Sicherheitsdatenblatt für Amphetaminsulfat – FAGRON GmbH & Co.KG 18. September 2008
- ↑ 8,0 8,1 Lazăr Edeleano: Über einige Derivate der Phenylmethacrylsäure und der Phenylisobuttersäure. In: Berichte der Deutschen chemischen Gesellschaft zu Berlin; 20. Jg. (1887), Band 3, S. 616–622. doi:10.1002/cber.188702001142
- ↑ EMCDDA 2001 Indikatoren für den Drogenmarkt – Sicherstellungen, Preis, Reinheit
- ↑ UNO-Statistik 2003 (englisch; PDF; 3,7 MB)
- ↑ 11,0 11,1 11,2 Center for Substance Abuse Research, University of Maryland: Amphetamines
- ↑ Nagayoshi Nagai: Kanyaku maou seibun kenkyuu seiseki (zoku). In: Yakugaku Zashi. Band 13, 1893, S. 901.
- ↑ 13,0 13,1 D. J. Heal, S. L. Smith, J. Gosden, D. J. Nutt: Amphetamine, past and present – a pharmacological and clinical perspective.. In: Journal of Psychopharmacology. 27, Nr. 6, 2013, S. 479–496, doi:10.1177/0269881113482532, PMID 23539642 (englisch).
- ↑ Edward M. Brecher and the Editors of Consumer Reports Magazine, 1972: The Consumers Union Report on Licit and Illicit Drugs. Kapitel 36. The amphetamines. (englisch)
- ↑ C. Bradley: The Behavior of Children Recieving Benzedrine. In: American Journal of Psychiatry. 1937, Nr. 94, S. 577–581.
- ↑ Madeleine P. Strohl: Bradley's Benzedrine Studies on Children with Behavioral Disorders. In: Yale Journal of Biology and Medicine. 2011, Nr. 84, S. 27–33.
- ↑ M. Tamura: Japan: stimulant epidemics past and present. In: Bulletin on Narcotics. United Nations Office on Drugs and Crime, 1. Januar 1989, S. 83–93, abgerufen am 14. Juli 2006.
- ↑ Regulatory News: Richwood's Adderall. In: Health News Daily. 22. Februar 1996, abgerufen am 29. Mai 2013.
- ↑ 19,0 19,1 PBS Statistics on stimulant use (englisch).
- ↑ United States General Accounting Office 2001: Attention Disorder Drugs. Few Incidents of Diversion or Abuse Identified by Schools (englisch, PDF; 1,9 MB).
- ↑ drugbank.ca: Amphetamine – Drug Interactions
- ↑ 22,0 22,1 Medice: Attentin
- ↑ shirecontent.com: ADDERALL (englisch, PDF; 179 kB)
- ↑ University of Maryland: Amphetamines – Informationen zu Amphetamin mit vielen Literaturangaben (englisch)
- ↑ R. B. Rothman, M. H. Baumann: Therapeutic and adverse actions of serotonin transporter substrates. In: Pharmacology & Therapeutics. Band 95, Nummer 1, Juli 2002, S. 73–88, PMID 12163129. (Review).
- ↑ D. Sulzer, M. S. Sonders, N. W. Poulsen, A. Galli: Mechanisms of neurotransmitter release by amphetamines: a review. In: Prog. Neurobiol.. 75, Nr. 6, April 2005, S. 406–433, doi:10.1016/j.pneurobio.2005.04.003, PMID 15955613. Volltext: bei Google Docs (Memento vom 30. Juni 2010 im Internet Archive)
- ↑ Eintrag zu Amphetamin in der DrugBank der University of Alberta.
- ↑ Rafael de la Torre u. a.: Clinical pharmacokinetics of amfetamine and related substances: monitoring in conventional and non-conventional matrices. In: Clinical Pharmacokinetics. 43, Nr. 3, März 2004, S. 177, doi:10.2165/00003088-200443030-00002, PMID 14871155.
- ↑ Poisons Information Monograph (PIM) für Amphetamine, abgerufen am 8. Dezember 2014.
- ↑ Drogenbeauftragte der Bundesregierung: Rauschgifttote nach Todesursachen 2010 - Länderabfrage, veröffentlicht am 24. März 2011, online abgerufen am 14. Oktober 2015
- ↑ Drogenbeauftragte der Bundesregierung: Rauschgifttote nach Todesursachen 2013 - Länderabfrage, veröffentlicht am 17. April 2014, online abgerufen am 14. Oktober 2015
- ↑ S. Berman u. a.: Abuse of amphetamines and structural abnormalities in the brain. In: Ann N Y Acad Sci. 1141, 2008, S. 195–220, doi:10.1196/annals.1441.031, PMID 18991959.
- ↑ R. C. Smith, J.M. Davis: Comparative effects of d-amphetamine, l-amphetamine and methylphenidate on mood in man. In: Psychopharmacology. 53, Nr. 1, 1977, S. 1–12, PMID 407607 (http://link.springer.com/article/10.1007%2FBF00426687).
- ↑ C. Kde Mariotti, R. S. Schuh, P. Ferranti, R. S. Ortiz, D. Z. Souza, F. Pechansky, P. E. Froehlich, R. P. Limberger: Simultaneous analysis of amphetamine-type stimulants in plasma by solid-phase microextraction and gas chromatography-mass spectrometry. In: J Anal Toxicol. 38(7), 2014 Sep, S. 432–437. PMID 25038769
- ↑ S. Pichini, O. García-Algar, A. T. Alvarez, M. Mercadal, C. Mortali, M. Gottardi, F. Svaizer, R. Pacifici: Pediatric exposure to drugs of abuse by hair testing: monitoring 15 years of evolution in Spain. In: Int J Environ Res Public Health. 11(8), 2014 Aug 14, S. 8267–8275. PMID 25153461
- ↑ M. L. Smith, D. C. Nichols, P. Underwood, Z. Fuller, M. A. Moser, R. Flegel, D. A. Gorelick, M. N. Newmeyer, M. Concheiro, M. A. Huestis: Methamphetamine and amphetamine isomer concentrations in human urine following controlled vicks vapoinhaler administration. In: J Anal Toxicol. 38(8), 2014 Oct, S. 524–527. PMID 25217541
- ↑ H. R. Lin, C. C. Liao, T. C. Lin: Improved identification of multiple drugs of abuse and relative metabolites in urine samples using liquid chromatography/triple quadrupole mass spectrometry coupled with a library search. In: Rapid Commun Mass Spectrom. 28(19), 2014 Oct 15, S. 2043–2053. PMID 25156593
- ↑ S. Macdonald, C. J. Cherpitel, T. Stockwell, G. Martin, S. Ishiguro, K. Vallance, J. Brubacher: Concordance of self-reported drug use and saliva drug tests in a sample of emergency department patients. In: J Subst Use. 19(1-2), 2014 Mar 1, S. 147–151. PMID 25104914
- ↑ T. Mackuľak, J. Skubák, R. Grabic, J. Ryba, L. Birošová, G. Fedorova, V. Spalková, I. Bodík: National study of illicit drug use in Slovakia based on wastewater analysis. In: Sci Total Environ. 2014 Oct 1; 494-495, S. 158–165. PMID 25046607
- ↑ M. Sundström, A. Pelander, I. Ojanperä: Comparison between drug screening by immunoassay and ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry in post-mortem urine. In: Drug Test Anal. 2014 Jun 20. PMID 24953563
- ↑ Nicolas Rasmussen: On Speed: The Many Lives of Amphetamine. NYU Press, 2008, ISBN 978-0-8147-7627-8.
- ↑ Drogen-Razzia: Größte Amphetamin-Menge seit 15 Jahren beschlagnahmt. In: Berliner Morgenpost. 8. Juni 2012. Abgerufen am 22. November 2013.
- ↑ Europäische Beobachtungsstelle für Drogen und Drogensucht: Drogenproblematik in Europa 2009 (PDF; 4 MB)
- ↑ Jahreskurzlage Rauschgift 2010, Daten zur Rauschgiftkriminalität des BKA.
- ↑ Daten zur Kriminalität in Deutschland 2010
- ↑ Arnd Krüger: Die Einordnung der Leistung Roger Bannisters in die Geschichte des Trainings für Mittel- und Langstrecke. In: J. Buschmann, S. Wassong (Hrsg.): Langlauf durch die olympische Geschichte. Festschrift für Karl Lennartz. Carl und Liselott Diem – Archiv, Köln 2005, ISBN 3-88338-015-6, S. 349–372.
- ↑ Ullrich gesteht Einnahme von Amphetamin. auf: berlinonline.de, 8. Juli 2002, abgerufen am 8. August 2008.
- ↑ NADA (Hrsg.).THE 2014 PROHIBITED LIST INTERNATIONAL STANDARD. Prohibited List 2014 (PDF).
- ↑ drugcom.de über die Gefahren des Konsums
- ↑ Gabriel Galli, Jochen Wolffgramm: Long-term voluntary D-amphetamine consumption and behavioral predictors for subsequent D-amphetamine addiction in rats. In: College on Problems of Drug Dependence (Hrsg.): Science Direct – Drug and Alcohol Dependence. Vol. 73, Nr. 1, Elsevier, Amsterdam u. a. 7. Januar 2004, S. 51–60, doi:10.1016/j.drugalcdep.2003.09.003 (Kostenpflichtig, Kostenlos: Abstract, Article Outline, abgerufen am 23. September 2010).
- ↑ Jan Dirk Blom: A Dictionary of Hallucinations. Springer 2009, ISBN 978-1-4419-1223-7, S. 122.
- ↑ A. Testa, R. Giannuzzi, F. Sollazzo, L. Petrongolo, L. Bernardini, S. Dain: Psychiatric emergencies (part II): psychiatric disorders coexisting with organic diseases. In: European Review for Medical and Pharmacological Sciences. Band 17, Suppl 1, Februar 2013, S. 65–85, PMID 23436669. PDF.
- ↑ S2-Leitlinie: Psychische und Verhaltensstörungen durch Kokain, Amphetamine, Ecstasy und Halluzinogene, AWMF-Registernummer 076/007 (online: Volltext (Memento vom 2. Januar 2005 im Internet Archive)), Stand 10/2004.
- ↑ J. G. Bramness u. a.: Amphetamine-induced psychosis–a separate diagnostic entity or primary psychosis triggered in the vulnerable? In: BMC psychiatry. Band 12, 2012, S. 221, doi:10.1186/1471-244X-12-221. PMID 23216941. PMC 3554477 (freier Volltext).
- ↑ American Academy of Neurology vom 20. Februar 2011: Using Amphetamines May Increase Risk of Parkinson’s Disease (abgerufen 22. Februar 2011).
- ↑ 56,0 56,1 Europol: The „Dirty“ and Dangerous Side Effects of Synthetic Drugs Production. (englisch).
- ↑ Anlage III zu § 1 Abs. 1 BtMG
- ↑ Anlage II zu § 1 Abs. 1 BtMG.
- ↑ Schedule II Section d des CSA (englisch).
- ↑ § 2 BtMVV (Verschreiben durch einen Arzt).
- ↑ 4. BtMÄndV Art. 4 vom 23. Dezember 1992 (BGBl. 1992 I S. 2483; 2487).
- ↑ 62,0 62,1 Rechtsinformationssystem des Bundeskanzleramts Österreich, Bundesrecht konsolidiert: Gesamte Rechtsvorschrift für Suchtgiftverordnung, Fassung vom 30. März 2014.
- ↑ 10. BtMÄndV Art. 1 Nr. 1 Buchst. b; Art. 1 Nr. 3; Art. 3 (BGBl. I, S. 74).
- ↑ Gerhard Gründer, Otto Benkert: Handbuch der Psychopharmakotherapie. Springer, 2012, ISBN 978-3-642-19844-1, S. 1117 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Dexamphetamin auf pharmawiki.ch
- ↑ Dexamfetamin, Attentin® (Medice Arzneimittel). In: Pharmazeutische Zeitung online. Abgerufen am 5. August 2013.
- ↑ Elaine Moore: The Amphetamine Debate: The Use of Adderall, Ritalin and Related Drugs for Behavior Modification, Neuroenhancement and Anti-Aging Purposes. McFarland, 2010, ISBN 978-0-786-48012-8 (Eingeschränkte Vorschau in der Google Buchsuche), S. 90, Corrigendum: Dexamphetamine statt Lisdexamphetamine.
- ↑ Drugs.com Adderall
- ↑ Lisdexamfetamin, Elvanse® (Shire). In: Pharmazeutische Zeitung online. Abgerufen am 5. August 2013.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Amphetamin aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |