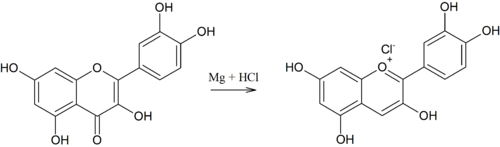| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Anthocyanidine

Anthocyanidine stellen den farbgebenden Anteil der Anthocyane (einer Gruppe von Pflanzenfarbstoffen) dar. Anthocyane bestehen strukturell aus einem Anthocyanidin, dem Aglycon, und glycosidisch gebundenen Zuckern. Durch das Spektrum an natürlich gebildeten Zuckern ergibt sich eine Vielfalt von ca. 250 Anthocyanen.
Geschichte
Wesentliche Beiträge zur Strukturaufklärung der Anthocyane leistete Richard Willstätter[1][2][3][4][5][6][7][8][9][10][11], der für seine systematische Pionierarbeit auf diesem Gebiet den Nobelpreis für Chemie im Jahre 1915 erhielt. Es gelang ihm, aus Pflanzenextrakten die Anthocyane zu isolieren sowie hieraus durch Abbaureaktionen die Anthocyanidine freizusetzen und zu identifizieren. Letztlich sind nur circa zehn Anthocyanidine als natürliche Stammverbindungen bekannt.
Struktur
Die glycosidische Bindung in Anthocyanen kann säurekatalysiert gespalten werden und so das Anthocyanidin freigesetzt werden. Anthocyanidine sind mehrfach hydroxysubstituierte 2-Phenylchromenyliumsalze (Flavyliumsalze)[12], als Gegenion von Benzopyryliumsalzen fungieren in der Natur meist Carboxylate diverser wasserlöslicher Säuren, bei Laborpräparaten häufig Chlorid. Zur Kristallisation benutzte man früher Pikrate. Mit Abstand am wichtigsten ist in dieser Pflanzenfarbstoffgruppe das Cyanidin, gefolgt von Delphinidin und Pelargonidin. Deren Methylether Peonidin, Petunidin und Malvidin finden sich ebenfalls häufig. Myrtillin ist ein Glycosid des Delphinidins.
| Anthocyanidin | CAS (a) | Grundstruktur (R3 = −OH) | R1, R2 | - | R5 | R6 | R7 | - | λmax(b) | - | pKS1(c) | pKS2 | pKS3 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Guibourtinidin(d) | 13544-54-2 | 
|
−H, −H | −H | −H | −OH | 504 nm | .... | .... | .... | ||||
| Fisetinidin(d) | 2948-76-7 | −OH, −H | −H | −H | −OH | 520 nm | .... | .... | .... | |||||
| Robinetinidin(d) | 3020-09-5 | −OH, −OH | −H | −H | −OH | 532 nm | .... | .... | .... | |||||
| Pelargonidin(d) | 134-04-3 | −H, −H | −OH | −H | −OH | 523 nm | n.b. | .... | .... | |||||
| Cyanidin(d) | 528-58-5 | −OH, −H | −OH | −H | −OH | 538 nm | 2,98 ± 0,05 | 7,5 | .... | |||||
| Peonidin (Paeonidin) | 134-01-0 | −OCH3, −H | −OH | −H | −OH | 536 nm | 2,09 ± 0,10 | 6,8 | .... | |||||
| Rosinidin | 4092-64-2 | −OCH3, −H | −OH | −H | −OCH3 | .... | .... | .... | ||||||
| Delphinidin(d) | 528-53-0 | −OH, −OH | −OH | −H | −OH | 548 nm | 1,56 ± 0,20 | 5,85 | .... | |||||
| Pulchellidin | 19077-86-2 | −OH, −OH | −OCH3 | −H | −OH | .... | .... | .... | ||||||
| Petunidin | 1429-30-7 | −OCH3, −OH | −OH | −H | −OH | 547 nm | .... | .... | .... | |||||
| Europinidin | 19077-87-3 | −OCH3, −OH | −OCH3 | −H | −OH | .... | .... | .... | ||||||
| Malvidin | 643-84-5 | −OCH3, −OCH3 | −OH | −H | −OH | 546 nm | 1,76 ± 0,07 | 5,36 ± 0,04 | 8,39 ± 0,07 | |||||
| Capensinidin | 19077-85-1 | −OCH3, −OCH3 | −OCH3 | −H | −OH | .... | .... | .... | ||||||
| Hirsutidin | 4092-66-4 | −OCH3, −OCH3 | −OH | −H | −OCH3 | .... | .... | .... | ||||||
| Aurantinidin(d)(e) | 25041-66-1 | −H, −H | −OH | −OH | −OH | .... | .... | .... | ||||||
| Quercetagetinidin(d)(f) | 42529-06-6 | −OH, −H | −OH | −OH | −OH | 519 nm | .... | .... | .... | |||||
| 6-Hydroxydelphinidin(d) | 178436-68-5 | −OH, −OH | −OH | −OH | −OH | .... | .... | .... | ||||||
|
(a) CAS-Nummern der Chloride.
(b) UV-Absorption in Methanol mit 0,1 % HCl.[13][14] Anthocyanidine absorbieren Licht circa 10 nm langwelliger als Anthocyanidin-Glycoside (bathochrome Verschiebung).
(d) unsubstituierte Stammverbindungen
(e) 6-Hydroxypelargonidin
(f) 6-Hydroxycyanidin
| ||||||||||||||
Anthocyanidine weisen in Position 2 immer einen p-Hydroxyphenyl-Substituenten (B-Ring) sowie in Position 3 eine Hydroxygruppe auf. Die wichtigsten natürlichen Anthocyanidine sind in 5- und 7-Position des A-Rings hydroxysubstituiert.
Neben der Gruppe der Anthocyanidine gibt es noch die kleine Gruppe der 3-Desoxyanthocyanidine (mit R3 = H). Hierzu zählen
- Apigeninidin (3-Desoxypelargonidin, Gesneridin)
- Luteolinidin (3-Desoxycyanidin) und als Methylether Diosmetinidin (3-Desoxypeonidin)
- Tricetinidin (3-Desoxydelphinidin)
- Columnidin
3-Desoxyanthocyanidine verhalten sich in Bezug auf Farbe und Acidität[18] wie Anthocyanidine.
Eigenschaften
Anthocyanidine sind licht-, luft- und temperaturempfindlich, bei pH-Werten unter 3 sind sie in Form ihrer Flavyliumsalze am stabilsten.
Anthocyanidine absorbieren Licht im sichtbaren Bereich zwischen 450 und 650 nm und erscheinen daher rot, violett oder blau. Der Wellenlängenbereich wird außer von der Molekülstruktur auch vom pH-Wert der Lösung beeinflusst. Im sauren Milieu überwiegt die Rotfärbung, im basischen sind vor allem Blau- und Violetttöne zu finden.
pH-Abhängigkeit des Farbumschlags
Die Farbänderungen beruhen auf chemischen Reaktionen.[19]
- Bei pH-Werten unter 3 sind sie rot gefärbt und liegen in Form von Flavyliumkationen vor.
- pH-Werte zwischen 4 und 5 führen durch Hydroxylierung zu farblosen Carbinol-Pseudobasen („Leucobasen“, Chromenol).
- Bei pH-Werten zwischen 5 und 7 liegen sie als Flavenole mit chinoider Struktur vor und sind purpur.
- Bei pH-Werten zwischen 7 und 8 wird dieses Molekül zum Flavenolatanion deprotoniert, das eine blaue Farbe aufweist. Hier sind die Π-Elektronen im gesamten Molekül über eine längstmögliche Distanz delokalisiert und daher mit niedrigster Lichtenergie anregbar.
- pH-Werte ab 8 führen bei Fehlen von Glycosidgruppen in 5-Position auch zu Flavenolat-Dianionen, jedoch konkurriert im Alkalischen die hydrolytischen Öffnung des Pyranringes. Das Molekül wird dabei irreversibel zu einem gelben[20] Chalkon-Anion umgewandelt.[21]
- Verglichen mit den pKS-Werten von Dihydroxybenzolen (pKS ca. 9,5 und 11,7) sind Anthocyanidine mehr als 1000-fach acider. Flavyliumsalze in Wasser sind mehr als 10-fach saurer als Ameisensäure (pKS 3,8).
Synthese
Robert Robinson kam 1921 aufgrund der Analyse der Substitutionsmuster der Flavonoide zu der Erkenntnis, dass die Flavonoide und damit die Anthocyanidine biochemisch aus einer C6- und einer C6-C3-Einheit aufgebaut sein müssen. 1953 erweiterten Arthur Birch und F. W. Donovan diese Theorie: Die Flavonoid-Biosynthese muss von einer p-Hydroxyzimtsäure und drei Acetateinheiten ausgehen, als Intermediat wird eine Polyketosäure gebildet.
Synthetisch werden die Anthocyanidine vielfach nicht direkt, sondern über ähnliche Flavonoide hergestellt. Flavone sind redoxäquivalent mit Anthocyanidinen, Flavanone mit 3-Desoxyanthocyanidinen. Es sind zahlreiche Methoden bekannt, um Flavone, Flavanone und Flavonole zu den entsprechenden Anthocyanidinen bzw. 3-Desoxyanthocyanidinen zu reduzieren.[22]
Anthocyanidine
Präparativ sind die Anthocyanidine durch eine Knoevenagel-Kondensation von 3,5-dimethoxysubstituierten Salicylaldehyden mit α-Methoxyacetophenonen zugänglich. Das Primärprodukt tautomerisiert unter Ringschluss zum α-Flavanol, das bei Zugabe von Säure Wasser abspaltet und das methoxysubstituierte Flavylium-Salz ergibt (Robinson-Anellierung). Methylether-Gruppen lassen sich schonend mit Iodwasserstoffsäure abspalten.
Flavone
Die Allan-Robinson-Kondensation[23] sowie deren intramolekulare Variante, die Baker-Venkataraman-Umlagerung, führen durch basenkatalysierte Kondensationsreaktionen zu Flavonen.
Flavonole
Bereits 1908 entdeckte Karl von Auwers durch Zufall eine Ringerweiterungsreaktion (Auwers-Reaktion), die von Cumaronen zu Flavonolen führt.[24][25][26][27][28]
Die Algar-Flynn-Oyamada-Reaktion ist eine basenkatalysierte Ringschlussreaktion mit Wasserstoffperoxid. Hierbei werden Flavon-Zwischenstoffen bis zum Flavonol oxidiert.
Reduktion
Mit klassischen milden Reduktionmethoden können spezifisch Flavone zu 3-Desoxyanthocyanidinen bzw. Flavonole zu Anthocyanidinen reduziert werden. Mit drastischen Reduktionsmethoden (Natriumamalgam in Wasser) lassen sich jedoch auch Flavanone zu rot gefärbten Flavyliumsalzen umsetzen.[29]
Siehe auch
Biologische Bedeutung
Wichtige natürliche Farbmittel bestehen aus Anthocyanidinen. In Früchten enthaltene Anthocyanidine werden durch ihr antioxidatives Potential als Radikal-Fänger für die Gesundheit förderlich angesehen. Rotweine enthalten zwar – wie allgemein bekannt – giftiges Ethanol, aber der Gehalt an Anthocyanidinen mag die Weintrinkenden entschuldigen. Um dies auf eine wissenschaftliche Grundlage zu stellen, wurden in Rotweinen vorkommende Anthocyanidine wurden mittels Elektronenspinresonanz-Spektroskopie und „spin trapping“ systematisch untersucht. Die Inhaltsstoffe fingen das Radikal des Superoxidanions mit hoher Wirksamkeit ab.[30]
Übersichtsartikel
- H. Halbwirth: The Creation and Physiological Relevance of Divergent Hydroxylation Patterns in the Flavonoid Pathway. In: Int J Mol Sci. Nr. 11, 2010, S. 595–621, PMC 2852856 (freier Volltext).
Einzelnachweise
- ↑ R. Willstätter, A. E. Everest: Untersuchungen über die Anthocyane. I. Über den Farbstoff der Kornblume. In: Liebigs Ann. Chem. Bd. 401, 1913, S. 189–232, doi:10.1002/jlac.19134010205.
- ↑ R. Willstätter, T. J. Nolan: Untersuchungen über die Anthocyane. II. Über den Farbstoff der Rose. IN: Liebigs Ann. Chem. Bd. 408, 1915, S. 1–14, doi:10.1002/jlac.19154080102.
- ↑ R. Willstätter, H. Mallison: Untersuchungen über die Anthocyane. III. Über den Farbstoff der Preiselbeere. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 15–41, doi:10.1002/jlac.19154080103.
- ↑ R. Willstätter, E. K. Bolton: Untersuchungen über die Anthocyane. IV. Über den Farbstoff der Scharlachpelargonie. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 42–61, doi:10.1002/jlac.19154080104.
- ↑ R. Willstätter, W. Mieg: Untersuchungen über die Anthocyane. V. Über ein Anthocyan des Rittersporns. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 61–82, doi:10.1002/jlac.19154080105.
- ↑ R. Willstätter, E. H. Zollinger: Untersuchungen über die Anthocyane. VI. Über die Farbstoffe der Weintraube und der Heidelbeere. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 83–109, doi:10.1002/jlac.19154080106.
- ↑ R. Willstätter, K. Martin: Untersuchungen über die Anthocyane. VII. Über den Farbstoff der Althaea rosea. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 110–121, doi:10.1002/jlac.19154080107.
- ↑ R. Willstätter, W. Mieg: Untersuchungen über die Anthocyane. VIII. Über den Farbstoff der wilden Malve. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 122–135, doi:10.1002/jlac.19154080108.
- ↑ R. Willstätter, T. J. Nolan: Untersuchungen über die Anthocyane. IX. Über den Farbstoff der Päonie. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 136–146, doi:10.1002/jlac.19154080109.
- ↑ R. Willstätter, H. Mallison: Untersuchungen über die Anthocyane. X. Über Variationen der Blütenfarben. In: Liebigs Ann. Chem. Bd. 408, 1915, S. 147–162, doi:10.1002/jlac.19154080110.
- ↑ R. Willstätter, E. K. Bolton: Untersuchungen über die Anthocyane. XI. Über das Anthocyan der rotblühenden Salviaarten. In: Liebigs Ann. Chem. Bd. 412, 1917, S. 113–136, doi:10.1002/jlac.19174120202.
- ↑ Eintrag: Anthocyanidins. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.A00379 (Version: 2.3.1).
- ↑ Analytische Daten diverser Anthocyanidine.
- ↑ Vergleichende Darstellung der VIS-Spektren.
- ↑ H. Pyysalo, O. Mäkitie: Spectrometric Studies on the Acid Dissociation of Anthocyanins in Aqueous Solutions. In: Acta Chem. Scand. Bd. 27, 1973, S. 2681–2682 (PDF).
- ↑ Robert E. Asenstorfer, Patrick G. Iland, Max E. Tate, Graham P. Jones: Charge equilibria and pKa of malvidin-3-glucoside by electrophoresis. In: Analytical Biochemistry. Bd. 318, 2003, S. 291–299 doi:10.1016/S0003-2697(03)00249-5.
- ↑ Josh Hurwitz: Determining the Acid/Alkali and Color Properties of the Anthocyanin Delphinidin-3-Monoglucoside in Hydrangea Macrophylla. (http://jehurwitz.weebly.com/uploads/1/3/4/0/13409318/extended_essay.pdf).
- ↑ pKS3 = 8,06 für Apigeninidin bestimmt von L. Costantino, G. Rastelli, M. Rossi, A. Albasini: Quantitative measurement of proton dissociation and tautomeric constants of apigeninidin. In: J. Chem. Soc., Perkin Trans. 2. 1995, S. 227–234, doi:10.1039/P29950000227.
- ↑ Institut Dr Flad / www.amazingBytes.net: Naturstoffe als Indikatoren – Projektarbeiten am Institut Dr. Flad. Abgerufen am 6. Februar 2022.
- ↑ Gelbe Farbstoffe absorbieren unter 400 nm, vgl. Quercetin, Chalcon bei 350 nm.
- ↑ Raymond Brouillard: Chemical Structure of Anthocyanines. In: Pericles Markakis (Hrsg.): Anthocyanins as Food Colors. Elsevier, 2012, ISBN 978-0-323-15790-2, S. 1–40 (pH-Abhängigkeit, Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Y. Asahina, G. Nakagome, M. Inubuse: Über die Reduktion der Flavon- und Flavanon-Derivate (V. Mitteilung über die Flavanon-glucoside). In: Ber. Dtsch. Chem. Ges. Bd. 62, 1929, S. 3016–3021, doi:10.1002/cber.19290621112 und dort zit. Lit.
- ↑ Vorlage:OrgSynth
- ↑ K. Auwers, K. Müller: Umwandlung von Benzal-cumaranonen in Flavonole. In: Ber. Dtsch. Chem. Ges. Bd. 41, 1908,. S. 4233–4241, doi:10.1002/cber.190804103137.
- ↑ K. v. Auwers, P. Pohl: Über die Umwandlung von Benzalcumaranonen in Flavonole. In: Liebigs Ann. Chem. Bd. 405, 1914, S. 243–294, doi:10.1002/jlac.19144050302.
- ↑ K. v. Auwers, P. Pohl: Eine Synthese des Fisetins. In: Ber. Dtsch. Chem. Ges. Bd. 48, 1915, S. 85–90, doi:10.1002/cber.19150480114.
- ↑ K. v. Auwers: Zur Bildung von Flavonolen aus Benzal-cumaranonen. In: Ber. Dtsch. Chem. Ges. Bd. 49, 1916, S. 809–819, doi:10.1002/cber.19160490188.
- ↑ K. v. Auwers, E. Auffenberg: Über Cumaranone und Hydrindone. In: Ber. Dtsch. Chem. Ges. Bd. 52, 1919, S. 92–113, doi:10.1002/cber.19190520114.
- ↑ F. Tiemann, W. Will: Ueber das Hesperidin, ein Glucosid der Aurantiaceen, und seine Spaltungsproducte. In: Ber. Dtsch. Chem. Ges. Bd. 14, Nr. 1, 1881, S. 946–974, hier S. 954 (Digitalisat auf Gallica).
- ↑ Maria Garcia-Alonso, Gerald Rimbach, Masaaki Sasai, et al.: Electron spin resonance spectroscopy studies on the free radical scavenging activity of wine anthocyanins and pyranoanthocyanins. In: Molecular Nutrition & Food Research. Bd. 49, Heft 12, 2005, S. 1613–4125, doi:10.1002/mnfr.200500100.
| Dieser Artikel basiert ursprünglich auf dem Artikel Anthocyanidine aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |