| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Immunsystem
Als Immunsystem (lat. immunis ‚unberührt‘, ‚frei‘, ‚rein‘) wird das biologische Abwehrsystem höherer Lebewesen bezeichnet, das Gewebeschädigungen durch Krankheitserreger verhindert. Es entfernt in den Körper eingedrungene Mikroorganismen, fremde Substanzen und ist außerdem in der Lage, fehlerhaft gewordene körpereigene Zellen zu zerstören. Das Immunsystem ist ein komplexes Netzwerk aus verschiedenen Organen, Zelltypen und Molekülen und der zentrale Forschungsgegenstand der Immunologie.
Das Immunsystem hat eine große Bedeutung für die körperliche Unversehrtheit von Lebewesen, denn praktisch alle Organismen sind ständig den Einflüssen der belebten Umwelt ausgesetzt; manche dieser Einflüsse stellen eine Bedrohung dar: Wenn schädliche Mikroorganismen in den Körper eindringen, kann dies zu Funktionsstörungen und Krankheiten führen. Typische Krankheitserreger sind Bakterien, Viren und Pilze, sowie einzellige (z. B. Protozoen wie Plasmodien) beziehungsweise mehrzellige Parasiten (z. B. Bandwürmer).
Auch Veränderungen im Inneren des Körpers können die Existenz eines Lebewesens bedrohen: Wenn normale Körperzellen im Laufe der Zeit ihre gesunde Funktion verlieren, dann sterben sie meist ab und müssen abgebaut werden (Nekrose) oder bauen sich dabei selbst ab (Apoptose). In seltenen Fällen können sie auch krankhaft entarten und zur Entstehung von Krebs führen.
Alle Lebewesen verfügen daher über Schutzfunktionen. Schon einfache Organismen besitzen einen solchen Abwehrmechanismus, die so genannte Angeborene Immunantwort. Sie entstand bereits sehr früh in der Stammesgeschichte der Lebewesen und wurde seitdem weitgehend unverändert beibehalten. Die Wirbeltiere entwickelten zusätzlich eine komplexe, anpassungsfähige, so genannte adaptive Immunabwehr, die sie noch effektiver vor Krankheitserregern schützt.
Die pflanzliche Immunantwort hat Ähnlichkeiten mit der angeborenen Immunantwort bei Tieren. Pflanzen besitzen keine adaptive Immunantwort, also auch keine T-Zellen oder Antikörper.
Einteilung
Es gibt zwei grundlegend verschiedene Mechanismen der Immunabwehr, je nachdem, ob diese angeboren und daher in gewisser Weise (vgl. aber unten: bow-tie-architecture) erregerunspezifisch, oder ob diese erworben und daher erregerspezifisch ist.
Angeborene oder unspezifische Immunabwehr
Schon sehr früh in der Stammesgeschichte der Lebewesen entwickelte sich die unspezifische oder angeborene Immunabwehr (engl. „innate immunity“). Dazu zählen anatomische und physiologische Barrieren wie Epithelien, aber auch zellvermittelte Gegenwehr durch Phagozytose, sowie allgemein entzündliche Reaktionen und das Komplementsystem. Die angeborene Immunantwort findet innerhalb von Minuten statt, ist aber durch die Erbinformation lebenslang festgelegt.
Adaptive oder spezifische Immunabwehr
Die spezifische oder adaptive Immunabwehr, früher auch „erworbenes Immunsystem“ genannt, entwickelte sich im Laufe der Phylogenese der Wirbeltiere aus der angeborenen Immunabwehr. Sie zeichnet sich durch die Anpassungsfähigkeit gegenüber neuen oder veränderten Krankheitserregern aus. Im Rahmen dieser Anpassung sind die Zellen der adaptiven Immunabwehr in der Lage, spezifische Strukturen (Antigene) der Angreifer zu erkennen und gezielt zelluläre Abwehrmechanismen und molekulare Antikörper zu bilden. Neben Antigenpräsentierenden Zellen (APC) wie Dendritischen Zellen, stellen zwei Gruppen von Zellen die wesentlichen Elemente der adaptiven Immunität dar. Die T-Lymphozyten, welche zum einen die zellvermittelte Immunantwort gewährleisten und zum anderen die B-Lymphozyten unterstützen, sowie die B-Lymphozyten selbst, die für die humorale Immunität verantwortlich sind, also für jene Abwehrmaßnahmen, die sich über sezernierte Antikörper gegen Eindringlinge in den Körperflüssigkeiten (Humores) richten. Nach der Infektion bleiben spezifische Antikörper und Gedächtniszellen erhalten, um bei erneutem Kontakt mit dem Krankheitserreger binnen kurzer Zeit eine angemessene Abwehrreaktion zu ermöglichen.
Das adaptive Immunsystem ersetzt aber nicht das angeborene, sondern arbeitet mit diesem zusammen. Die verschiedenen Bestandteile des Immunsystems bedingen sich gegenseitig. Erst durch ein gut koordiniertes Zusammenspiel der angeborenen und adaptiven Immunabwehr wird die komplexe Immunreaktion des Körpers ermöglicht.[1]
Erst in den Jahren 2005-2007 wurde das CRISPR-Cas-System in vielen Bakterien und Archaeen entdeckt, welches ein vollständiges adaptives Immunsystem gegen Viren und mobile DNA darstellt.[2][3][4]
Bestandteile des Immunsystems
Die Bestandteile des Immunsystems sind
- mechanische Barrieren, die ein Eindringen der Schädlinge verhindern sollen
- Zellen, wie zum Beispiel Granulozyten, natürliche Killerzellen (NK-Zellen) oder T-Lymphozyten. Sie sind teilweise zu spezialisierten Organen (→ Lymphatisches System) zusammengefasst.
- Proteine, die als Botenstoffe oder zur Abwehr von Krankheitserregern dienen
- psychische Immunfaktoren.
Mechanische und physiologische Barrieren
Die mechanischen und physiologischen Barrieren des Körpers sind die erste Verteidigungslinie gegen Krankheitserreger. Sie sorgen dafür, dass die Pathogene erst gar nicht in den Körper eindringen können oder ihn möglichst schnell wieder verlassen:
- Haut – äußere Schicht als Barriere, Talg, Schweiß und Normalflora als Wachstumsbremsen für pathogene Mikroorganismen
- Schleimhaut – Bindefunktion des Schleims
- Augen – Abtransportfunktion der Tränen, antimikrobielles Enzym Lysozym bekämpft Mikroorganismen
- Atemwege – Bindefunktion des Schleims, Abtransportfunktion der Flimmerhärchen
- Mundhöhle – antimikrobielles Enzym Lysozym im Speichel bekämpft Mikroorganismen
- Magen – Magensäure (die Salzsäure enthält) und Eiweiß abbauende Enzyme zerstören fast alle Bakterien und Mikroorganismen
- Darm – Infektabwehr durch anwesende Bakterien (Darmflora), Abtransportfunktion durch ständige Entleerung und das so genannte darmassoziierte Immunsystem (GALT = Gut Associated Lymphoid Tissue) und antibakterielle Proteine
- Harntrakt – Abtransportfunktion durch ständige Harnausspülung sowie osmotische Effekte der hohen Harnstoffkonzentration
Zelluläre Bestandteile
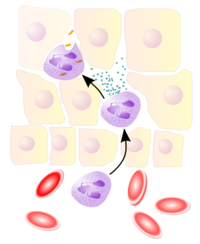
Die Zellen des Immunsystems zirkulieren in den Blutgefäßen und Lymphbahnen und kommen in den Geweben des Körpers vor. Dringt ein Krankheitserreger in den Körper ein, so können die Abwehrzellen ihn bekämpfen. Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können beispielsweise durch Aufnahme und Verdauung (Phagozytose) den Erreger selbst vernichten oder durch die Produktion von Immunmodulatoren und Zytokinen die Immunreaktion des Organismus steuern und andere Abwehrzellen zum Ort der Entzündung locken.
Granulozyten
Granulozyten (von lat. Granulum: Körnchen) machen den Großteil der weißen Blutkörperchen (Leukozyten) aus. Sie können die Blutbahn verlassen und ins Gewebe einwandern. Granulozyten haben in ihrem Zytoplasma zahlreiche Bläschen (Vesikel oder Granula genannt), die aggressive Stoffe enthalten, mit denen Krankheitserreger unschädlich gemacht werden können. Andere Stoffe (beispielsweise Histamin) spielen bei der Entzündungsreaktion und bei Allergien eine Rolle. Die unterschiedlichen Gruppen von Granulozyten werden nach ihrer Färbereaktion in der Giemsa-Färbung eingeteilt.
Die Neutrophilen Granulozyten machen 40 bis 50 Prozent der zirkulierenden Leukozyten aus. Aktiviert durch Zytokine, die vom Ort der Infektion ausgesondert werden, wandern sie aus den Blutgefäßen in das betroffene Gewebe ein. Die Granula der Neutrophilen enthalten unter anderem saure Hydrolasen, Defensine (30 % des Inhalts), Myeloperoxidase und Proteasen, wie Elastase, Kollagenase, Neuramidase und Cathepsin G. Dieser „Cocktail“ ermöglicht es den Neutrophilen, sich einen Weg durch das Gewebe zu bahnen und zu den Bakterien vorzudringen. Dort sind sie in der Lage, Krankheitserreger (beispielsweise Bakterien) unter anderem durch Phagozytose zu vernichten.
Eosinophile Granulozyten machen etwa 3-5 Prozent der Zellen im Differentialblutbild aus. Ihren Namen beziehen sie vom Farbstoff Eosin, mit dem sie angefärbt werden können. Auch Eosinophile sind zur Chemotaxis befähigt, d. h. sie können sich in Richtung eines Entzündungsortes fortbewegen. Eosinophile enthalten in ihren Granula basische Proteine, zum Beispiel das Major Basic Protein, die sie nach Stimulation durch Antikörper der IgE-Klasse freisetzen. Eosinophile spielen eine wichtige Rolle bei der Parasitenabwehr; bei einem Befall mit Parasiten kommt es daher zu einer starken Vermehrung der Eosinophilen im Blut. Auch bei Allergien ist die Anzahl der Eosinophile im Blut erhöht, was darauf hinweist, dass die Eosinophilen auch bei dieser Erkrankung eine – wenig zuträgliche – Rolle spielen.
Basophile Granulozyten besitzen zahlreiche grobe unregelmäßige Granula, die unter anderem Histamin und Heparin enthalten. Im Differentialblutbild machen sie nur einen geringen Anteil aus (< 2 Prozent). Wenn ihre Rezeptoren durch an IgE gebundene Allergene stimuliert werden, schütten Basophile toxische Mediatoren, wie Histamin und Plättchenaktivierenden Faktor (PAF) aus. Über die physiologische Bedeutung der Basophilen besteht aber weitgehend Unklarheit.
Makrophagen
Makrophagen (Riesenfresszellen) stellen ebenfalls einen Teil der Patrouille des Immunsystems dar. Makrophagen reifen aus Monozyten (einkernige weiße Blutkörperchen = mononukleäre Leukozyten) heran, welche die Blutbahn verlassen. Makrophagen halten sich im Gewebe auf, dort erkennen und fressen (phagozytieren) sie eingedrungene Erreger. Können die Erreger nicht durch die Makrophagen allein bekämpft werden, so können Makrophagen die adaptive Immunabwehr aktivieren. Dazu werden die aufgenommenen Teile der Erreger im Inneren der Makrophagen in einzelne Peptide (Epitope) zerlegt und durch MHC-II-Moleküle auf der Oberfläche präsentiert. Der Makrophage wird also zu einer Antigen-präsentierenden Zelle. Die Antigene können erst dadurch von T-Helferzellen erkannt werden, die daraufhin eine adaptive Immunantwort initiieren, die letztendlich zur Vernichtung des Erregers führt. Makrophagen spielen außerdem bei der Bekämpfung und Beseitigung von schädlichen Substanzen und Abfallprodukten (beispielsweise Teer aus Zigarettenrauch in der Lunge) eine entscheidende Rolle, weshalb sie gelegentlich auch als „Müllabfuhr des Körpers“ bezeichnet werden.
Natürliche Killerzellen
Die 1975 entdeckten Natürlichen Killerzellen (NK-Zellen) sind Teil der angeborenen Immunabwehr.[5] Obwohl NK-Zellen keine antigenspezifischen Rezeptoren auf ihrer Oberfläche tragen, werden sie zu den Lymphozyten gezählt, da sie eine gemeinsame Vorläuferzelle im Knochenmark haben.
NK-Zellen sind eine der ersten Verteidigungslinien im Kampf gegen Infektionen und Krebs, weil sie infizierte Zellen vernichten können, ohne vorher mit dem Krankheitserreger selbst in Kontakt gewesen zu sein. Sie verwenden dazu einen Mechanismus, der in den 1980er Jahren von dem schwedischen Immunologen Klas Kärre entdeckt wurde und als „Fehlendes Selbst“ (engl. „missing self“) bezeichnet wird.[6]
NK-Zellen erkennen unter anderem den MHC-I-Komplex, der auf nahezu allen gesunden Körperzellen vorkommt. Wird eine Zelle durch Viren infiziert oder wandelt sie sich in eine Tumorzelle um, so geht unter Umständen der MHC-I-Komplex auf der Oberfläche verloren. Das fein ausbalancierte Gleichgewicht von inhibierenden und aktivierenden Rezeptorsignalen wird dadurch zugunsten der NK-Zell-Aktivierung verschoben und die erkrankte Zelle fällt einer durch NK-Zellen ausgelösten Immunreaktion anheim.
Dendritische Zellen
Dendritische Zellen sind Zellen des Immunsystems, die sich je nach Typ aus Monozyten oder Vorläufern der T-Zellen entwickeln. Sie nehmen als Fresszellen (Phagozyten) Krankheitserreger auf, wandern in den nächsten Lymphknoten, und stimulieren die adaptive Immunabwehr indem sie die Antigene des zerlegten Erregers an ihrer Oberfläche den T-Lymphozyten präsentieren. Es genügt eine dendritische Zelle, um 100 bis 3.000 Antigen-spezifische T-Zellen zu aktivieren. Dies macht sie effizienter als z. B. Monozyten.[7] Dendritische Zellen sorgen auch für immunologische Toleranz gegenüber Selbstantigenen. Sie kommen vor allem in der Haut und in den Schleimhäuten vor.[8] Neue Forschungen zeigen, dass dendritische Zellen auch mit B-Zellen und NK-Zellen interagieren.[9]
T-Lymphozyten
T-Lymphozyten, auch T-Zellen genannt, entstehen im Knochenmark aus den Lymphoblasten und wandern in den Thymus, wo sie ausreifen (daher das T, von Thymus-abhängig). T-Zellen tragen an ihrer Oberfläche einen T-Zell-Rezeptor (TCR), mit dem jede T-Zelle jeweils ein spezifisches Antigen erkennen kann (Schlüssel-Schloss-Prinzip). Im Gegensatz zu den B-Lymphozyten, die auch freie Antigene erkennen, erkennen T-Zellen nur Antigene, die im Komplex mit MHC-Molekülen auf den Oberflächen von körpereigenen Zellen präsentiert werden. Die unterschiedlichen Typen von T-Zellen werden eingeteilt nach den Proteinen auf ihrer Zellmembran, die gleichzeitig für die Funktionen der Zellen wichtig sind: T-Helferzellen tragen beispielsweise das CD4-Protein (die Abkürzung CD steht für engl. Cluster of differentiation), die zytotoxischen T-Zellen haben das CD8-Protein auf ihrer Oberfläche.
T-Helferzellen
Die T-Helferzellen koordinieren die Immunreaktion. Sie erkennen über ihren spezifischen T-Zell-Rezeptor Antigene, die ihnen von den antigenpräsentierenden Zellen (dendritische Zellen, Makrophagen, B-Lymphozyten) auf MHC-II-Komplexen dargeboten werden. Diese Aktivierung veranlasst die T-Helferzelle sich zu teilen und ihre Botenstoffe freizusetzen: die Lymphokine der Zellen vom Subtyp TH1 führen dabei eher zur Verstärkung der zellulären Immunantwort, während TH2-Zellen mehr die Produktion von Antikörpern stimulieren.
Regulatorische T-Zellen
Die Mitte der 1990er erstmals beschriebenen regulatorischen T-Zellen tragen neben dem CD4-Rezeptor noch andere Proteine an ihrer Oberfläche (CD25, FoxP3).[10] Ihre Aufgabe ist die Modulation der Immunreaktion. Des Weiteren sind regulatorische T-Zellen vermutlich für die Unterdrückung einer überschießenden Immunantwort auf ansonsten 'harmlose' Antigene und Toleranzentwicklung gegen körpereigene Strukturen zuständig.
Zytotoxische T-Zellen
Die zytotoxischen T-Zellen können Antigene erkennen, die ihnen mithilfe der MHC-I-Komplexe präsentiert werden – körpereigene Zellen, die durch Krankheitserreger (zum Beispiel Viren) befallen sind, melden so ihren Zustand an das Immunsystem. Die zytotoxischen T-Zellen heften sich dann mit ihren T-Zell-Rezeptoren an diese Körperzellen; bei diesem Vorgang spielt ihr CD8-Rezeptor eine entscheidende Rolle.[11] Wenn sich noch weitere Rezeptoren, zum Beispiel der CD28-Rezeptor der zytotoxischen T-Zellen, an das fremde Eiweiß geheftet haben, beginnen sich die T-Zellen schnell zu vermehren, und schütten Substanzen aus, welche die infizierte oder krankhaft veränderte Zelle absterben lassen (sogenannte Apoptose, programmierter Zelltod).[12]
B-Lymphozyten
B-Lymphozyten, oder kurz B-Zellen, gehören ebenfalls zu den Leukozyten (weiße Blutkörperchen). Die Bezeichnung „B-Zellen“ stammte ursprünglich von ihrem Bildungsort in der Bursa Fabricii bei Vögeln. Bei Säugetieren entstehen die B-Zellen, wie alle anderen Abwehrzellen auch, im Knochenmark, daher erhielt der Buchstabe B hier nachträglich die Bedeutung bone marrow (engl. für Knochenmark). Bindet eine B-Zelle an den Stoff (Antigen), der zu ihrem Rezeptor passt, kann sie durch Lymphokine aktiviert werden, die von aktivierten T-Helferzellen ausgeschüttet werden. Die derart aktivierten B-Zellen können sich daraufhin zu antikörperproduzierenden Plasmazellen oder zu Gedächtniszellen entwickeln.
B-Zellen sind im Gegensatz zu T-Zellen in der Lage, auch freie Antigene zu erkennen und sie einer Immunreaktion zuzuführen.
Humorale Bestandteile
Die humoralen Bestandteile des Immunsystems (von lat. humor „Flüssigkeit“) bezeichnen verschiedene Plasmaproteine, die passiv im Blut, bzw. der Lymph- und Gewebsflüssigkeit zirkulieren. Sie sind im Gegensatz zu den Abwehrzellen nicht in der Lage, aktiv an den Ort einer Infektion zu wandern.
Antikörper
Zur Abwehr von in den Organismus eingedrungenen Bakterien, Bakterientoxinen, Viren oder anderen Fremdstoffen produzieren die B-Lymphozyten und Plasmazellen maßgeschneiderte Antikörper, die bestimmte Proteine oder auch Zuckerketten (Antigene) an der Oberfläche der Fremdstoffe erkennen und sich an diese heften können. Antikörper haben prinzipiell drei Funktionen:
- 1. Die so genannte Opsonierung. Das heißt, dass das Antigen durch den Fc-Teil (Teil der konstanten Kette des Antikörpers) für Phagozyten (Fresszellen) besser „sichtbar“ gemacht wird.
- 2. Durch den Antigen-Antikörperkomplex wird das so genannte Komplementsystem aktiviert, das zum einen wiederum als Opsonin (=Stoffe die Opsonieren) wirkt, zum anderen Chemotaxine (Lockstoffe für Zellen des Immunsystems) freisetzt und einen sogenannten MAK (Membran-Angriffs-Komplex) bildet, der Löcher in Zellmembranen verursacht.
- 3. Antikörper wirken direkt inaktivierend auf den Eindringling durch Verkleben und Bildung von großen Komplexen (je nach Antikörperklasse und Anzahl der Antigendeterminanten).
Die einfachsten Antikörper, die der so genannten IgG-Klasse, bestehen aus zwei identischen schweren Ketten und zwei identischen leichten Ketten. Die schweren Ketten sind unter anderem für die Verankerung des Antikörpers auf der Oberfläche von Granulozyten zuständig; die leichten Ketten bilden zusammen mit den schweren Ketten die für die Erkennung eines spezifischen Antigens verantwortliche Antigendeterminante im Fab-Fragment. Durch somatische Rekombination, somatische Hypermutation und Kombination verschiedener leichter und schwerer Ketten können Antikörper mehr als 100 Millionen verschiedene Fab-Fragmente bilden und damit eine Unzahl verschiedener Antigene erkennen.
Komplementsystem
Das Komplementsystem ist Teil der angeborenen Immunantwort, es besteht aus einer Gruppe von über 30 Plasmaproteinen mit ganz unterschiedlichen Eigenschaften. Ein Teil der zum Komplementsystem gehörenden Proteine sind zum Beispiel Proteasen, die sich an Mikroorganismen binden können und die Zellwände des Eindringlings schädigen, wodurch der Eindringling zerstört wird. Andere Proteine des Komplementsystems, die Anaphylatoxine, haben gefäßerweiternde Wirkung und fördern die Entzündungsreaktion. Viele Komplementfaktoren können außerdem Abwehrzellen zum Ort der Infektion locken und sind in der Lage, Fresszellen zu aktivieren, die die Eindringlinge dann verschlingen.
Interleukine
Die zu den Zytokinen gehörenden Interleukine sind körpereigene Botenstoffe, die von den Zellen des Immunsystems gebildet werden. Man kennt heutzutage bereits eine große Zahl von Interleukinen (IL-1 bis IL-35; Stand November 2009), die jeweils auf ganz unterschiedliche Abwehrzellen wirken – manche regen beispielsweise Leukozyten zu Wachstum, Reifung und Teilung an oder sorgen für deren Aktivierung.
Ablauf einer Immunreaktion
Falls Erreger die mechanischen Barrieren überwinden, mit denen sich der Körper vor einer Infektion schützt, so hängt der Ablauf der Immunreaktion davon ab, ob das Immunsystem bereits zuvor einmal einen Kontakt mit diesem bestimmten Erreger hatte.
Bei einer Erstinfektion beginnt die Immunreaktion meist mit den antigenpräsentierenden Zellen, hierzu gehören z. B. Makrophagen oder dendritische Zellen; diese Zellen sind als Teil der angeborenen Immunabwehr in der Lage, typische Merkmale von Krankheitserregern zu erkennen, ohne zuvor mit diesem Erreger Kontakt gehabt zu haben. Sie können die Krankheitserreger aufnehmen (phagozytieren) und in ihrem Inneren einschließen – förmlich „fressen“, daher werden sie auch als Fresszellen bezeichnet. Anschließend präsentieren sie Bruchstücke der Erreger an ihrer Oberfläche den Zellen der adaptiven Immunabwehr (B- und T-Lymphozyten), die daraufhin in einen aktivierten Zustand übergehen. Einige Abwehrzellen können daraufhin die Erreger durch Phagozytose oder die Ausschüttung aggressiver Substanzen direkt abtöten, andere beginnen mit der Produktion von Antikörpern, die an die Erreger binden und diese einerseits bewegungsunfähig und damit unschädlich machen, andererseits sie für die Vernichtung durch weitere Abwehrzellen markieren. Nach der ersten Infektion mit einem Erreger bleiben die Antikörper und so genannte Gedächtniszellen erhalten, um bei einer erneuten Infektion wesentlich schneller und effizienter auf den Eindringling reagieren zu können.
Ob nach einer Infektion tatsächlich auch eine Erkrankung auftritt, hängt von einem komplexen Wechselspiel des Immunsystems mit dem (ungebetenen) Gast ab. Eine Rolle spielen etwa die Menge der eingebrachten Erreger und deren krankmachenden Eigenschaften (Virulenz), sowie der Zustand des Immunsystems der betroffenen Person. So kann durch vorherigen Kontakt mit diesem Erreger bereits eine Immunität bestehen, die Erregerdosis oder -virulenz für einen Krankheitsausbruch zu gering sein oder das Immunsystem in der Lage sein, trotz Infektion Krankheitssymptome zu verhindern [inapparente Infektion oder stille Feiung (Immunisierung ohne Impfung oder Erkrankung)]. Bei intaktem Immunsystem und geringer Erregerdosis kann also eine Erkrankung wie beispielsweise eine Erkältung entweder überhaupt nicht ausbrechen oder einen weniger schweren Verlauf nehmen. Solange sich keine eindeutigen Symptome zeigen, kann der Verlauf einer Infektion kaum oder gar nicht vorhergesagt werden.
Wenn ein Krankheitserreger oder eine Tumorzelle keine Immunantwort erzeugt, dem Immunsystem also entkommt, wird dies als Immunescape bezeichnet.
Reifung und Alterung des Immunsystems
Das Immunsystem ist im Mutterleib und kurz nach der Geburt noch nicht in der Lage, effektiv Krankheitserreger zu bekämpfen. Der Fötus und Säugling ist daher auf die Schutzfunktion durch mütterliche Antikörper angewiesen (sog. Nestschutz), die er über die Plazenta, bzw. die Muttermilch aufnimmt. Bei vielen Säugetieren können Antikörper die Plazenta gar nicht passieren, die Aufnahme erfolgt dann über das Antikörper-reiche Kolostrum. Da die transplacentalen Antikörper im Blut des Babys mit einer Halbwertszeit von ungefähr 4 Wochen abgebaut werden, schützt diese passive Immunisierung lediglich 3 bis 4 Monate vor Infektion durch die meisten Keime. Stillen kann durch unspezifische IgAs, die sich den Schleimhäuten anlagern, noch etwas länger vor Infektionen der oberen Atemwege und Magen/Darmkeimen schützen.
In den ersten Lebensmonaten beginnt das Immunsystem, sich auf die Abwehr von Krankheitszellen vorzubereiten. Dies geschieht durch einen Vorgang der negativen Selektion; das heißt, der Körper bildet zunächst durch zufällige genetische Rekombination viele Millionen unterschiedlicher Abwehrzellen, von denen eine jede ein anderes Antigen erkennen kann. Im Anschluss werden solche Zellen eliminiert, die eine Immunreaktion auf körpereigene Strukturen veranlassen würden (Diesen Vorgang fasst man unter dem Begriff Selbsttoleranz zusammen). Bei den T-Zellen geschieht dies im Thymus, der Reifungsstätte der T-Zellen. Hier differenzieren sich die T-Zellen in die verschiedenen Typen (wie CD4+ und CD8+ Zellen) und werden anschließend mit körpereigenen Substanzen konfrontiert. Wenn eine T-Zelle einen dazu passenden Rezeptor trägt und an die körpereigene Struktur bindet, stirbt die T-Zelle ab. Das Immunsystem lernt so „fremd“ von „eigen“ zu unterscheiden.
Mit fortschreitendem Lebensalter steigert sich die Anfälligkeit des Menschen gegenüber Krankheiten und anderen Störungen wieder. Dies liegt vor allem daran, dass sich im Alter die Bildung von B- und T-Lymphozyten verringert. Des Weiteren sind die Abwehrzellen insgesamt weniger aktiv, was zu einer Schwächung der Immunabwehr führt, einhergehend mit erhöhtem Infekt- und Krebsrisiko. (→ siehe Hauptartikel Immunoseneszenz)
Störungen und Erkrankungen des Immunsystems
Wie bei allen biologischen Systemen können sich auch beim Immunsystem Fehler einschleichen. So kann das Immunsystem seine Fähigkeit verlieren, auf Erreger oder körpereigene Zellen angemessen zu reagieren: je nach Ursache der Störung kommt es entweder zu einer zu schwachen oder gar fehlenden Immunantwort oder zu einer zu starken, überschießenden Immunreaktion. Auch die Zellen des Immunsystems können maligne entarten und eine Krebserkrankung auslösen. Ebenso wird ein Einfluss von depressiven Störungen, Stress und anderen psychischen Erkrankungen auf das Immunsystem vermutet.
Immundefekte
Fehlen einzelne Komponenten der Immunantwort oder funktionieren diese nicht mehr richtig, so kann das Immunsystem Krankheitserreger nicht mehr effektiv bekämpfen und selbst Erkrankungen, die normalerweise harmlos sind, können lebensbedrohliche Verläufe annehmen. Immundefekte können angeboren oder erworben sein:
- Die schwere kombinierte Immundefizienz (SCID) ist eine Gruppe von angeborenen Immundefekten, die sich durch Beeinträchtigung sowohl der zellulären Immunabwehr als auch der humoralen Immunabwehr auszeichnen, daher die Bezeichnung „kombiniert“.
- Die erworbene Immunschwäche AIDS wird durch das HI-Virus ausgelöst, das sich durch den Befall der T-Helferzellen erfolgreich der Immunabwehr entzieht. Durch die Vermehrung des HI-Virus werden jedoch immer mehr Abwehrzellen zerstört, so dass meist nach einigen Jahren Inkubationszeit eine zunehmende Abwehrschwäche eintritt und die Anzahl von Infekten und Tumorerkrankungen zunimmt.
- Eine Neutropenie oder sogar Agranulozytose kann durch Nebenwirkungen bestimmter Medikamente (z. B. Zytostatika) oder durch Autoimmunerkrankungen ausgelöst werden und führt vor allem zu Schleimhautentzündungen und so genannten opportunistischen Infekten durch ansonsten harmlose Krankheitserreger.
- Weitere angeborene Immundefekte sind: Morbus Behcet, DiGeorge-Syndrom, selektiver Immunglobulin-A-Mangel und das Wiskott-Aldrich-Syndrom, bei denen jeweils ein bestimmter Anteil der Immunabwehr gestört ist.
Überschießende Immunantwort
- Autoimmunerkrankungen: Nicht immer funktionieren die Schutzmechanismen der Selbsttoleranz fehlerfrei, so dass es zu gefährlichen Autoimmunkrankheiten kommen kann, bei denen das Immunsystem körpereigene Strukturen angreift. Bei diesen Krankheiten ist das üblicherweise sehr gut ausbalancierte Gleichgewicht zwischen einerseits den potentiell selbstzerstörerisch wirkenden (autoreaktiven) T-Zellen und andererseits den regulatorischen T-Zellen gestört, die die Ersteren eigentlich in „Schach halten“ sollen. Einige Beispiele für Autoimmunerkrankungen sind:
- Diabetes Typ I, verursacht durch Antikörper gegen Beta-Inselzellen der Bauchspeicheldrüse.
- Rheumatoide Arthritis, bei der es durch eine Immunreaktion zu einer Entzündung der Gelenkinnenhaut kommt.
- Multiple Sklerose, verursacht durch Antikörper gegen die Myelinscheide von Nervenfasern.
- Allergie/Heuschnupfen: Das Immunsystem kann die Fähigkeit verlieren, auf fremde Eiweiße angemessen zu reagieren. Die übermäßige Aktivierung von Basophilen (und Eosinophilen), insbesondere aber der ortsständigen Mastzellen, kann zur allergischen Reaktionen, wie zum Beispiel Heuschnupfen, führen. Eine systematische Aktivierung dieser Zellen, also die Aktivierung im ganzen Körper, kann schwere Symptome bis hin zum anaphylaktischen Schock auslösen.
Krebserkrankungen des Immunsystems
Auch die Zellen des Immunsystems können bösartig entarten und so zu Krebserkrankungen führen, die meist den gesamten Körper befallen und sich vor allem in den Organen des Immunsystems abspielen und zur Abnahme der Immunabwehr und Verdrängung der normalen Blutbildung im Knochenmark führen. Durch die große Zahl unterschiedlicher Zellen und deren Vorläufer gibt es eine Vielzahl von verschiedenen Krebserkrankungen mit ganz unterschiedlichen Symptomen und Krankheitsverläufen, die aber grob in zwei Gruppen eingeteilt werden können: Geht der Krebs von den Vorläuferzellen im Knochenmark aus, so spricht man von Leukämien, die akut oder chronisch verlaufen können. Bösartige Tumoren der Lymphknoten nennt man Lymphknotenkrebs oder malignes Lymphom.
Andererseits ist ein therapeutischer Ansatz bei Krebserkrankungen, die Krebsimmuntherapie, die Aktivierung des Immunsystems gegen Tumorzellen.
Sonstige Schwachpunkte des Immunsystems
- Haben Viren sich in eine Schicht eingehüllt, die der Körper nicht als fremd erkennt (beispielsweise eine Schicht aus Lipiden), so sind sie nicht erkennbar.
- Im Gegensatz zu Krankheitserregern verursachen Tumorzellen keine Entzündungsreaktion, es kommt daher nicht zu einer Aktivierung der Immunantwort. Einige Tumore haben die Eigenschaft, sich regelrecht zu tarnen. Wenn keine tumorassoziierten Antigene (TAA) von den Krebszellen gebildet werden, erkennt das Immunsystem die Krebszelle daher nicht und es kommt zu Krebswachstum und/oder Metastasierung.[13]
- Das Immunsystem schützt nach heutigem Kenntnisstand nicht vor Prionen (infektiöse Proteine), sondern scheint – im Gegenteil – eine Rolle bei der Ausbreitung der Prionenerkrankung zu spielen. So waren beispielsweise in einem Experiment Mäuse mit defektem Immunsystem immun gegen eingebrachte Prionen, während Tiere mit funktionierendem Immunsystem eine Erkrankung entwickelten.[14]
Einflüsse auf das Immunsystem
Bei einem intakten Immunsystem spricht man von Immunkompetenz. Die Abwehrfunktion kann auf verschiedene Weise positiv oder negativ beeinflusst werden:
Allgemeine Stärkung des Immunsystems
Die Redewendungen "Stärkung des Immunsystems" und "Stärkung der Abwehrkräfte" werden häufig als Claim in der Werbung für Nahrungsergänzungsmittel, Functional Food und alternativmedizinische Heilmittel verwendet. So nimmt auch das Heilfasten für sich in Anspruch, das Immunsystem zu stärken. Problematisch sind hierbei fehlende medizinische Definitionen dafür, was unter "Stärkung" zu verstehen ist. Solche Verweise auf allgemeine, nichtspezifische Vorteile eines Produkts sind nach EU-Recht laut Artikel 10 Absatz 3 der Health-Claims Verordnung verboten, sofern ihnen nicht eine durch die Europäische Behörde für Lebensmittelsicherheit genehmigte spezielle gesundheitsbezogene Angabe beigefügt ist. Für eine Aufnahme in die entsprechende Positivliste genehmigter Angaben muss die Art und Weise, in der das Produkt auf das Immunsystem wirkt, angegeben und die Wirksamkeit wissenschaftlich belegt werden.
Ein gesundes und kräftiges Immunsystem kann Menschen dabei helfen, diverse Krankheitserreger zu bekämpfen und manchmal damit auch einen Krankheitsausbruch zu verhindern oder Krankheitssymptome zu mildern, beziehungsweise den Krankheitsverlauf zu verkürzen.
Als Grundlage für ein gesundes Immunsystem gelten eine ausgewogene Ernährung des Menschen, die alle für den Organismus notwendigen Stoffe wie beispielsweise Mineralstoffe (besonders Eisen, Zink und Selen) und Vitamine enthält, und ausreichend Schlaf;[15] des Weiteren sollte lange andauernder (chronischer) Stress vermieden werden.[16]
Als geeignete Maßnahmen zur Steigerung der Immunfunktion gelten regelmäßige Bewegung, insbesondere sportliches Ausdauertraining,[17] sowie regelmäßige Abhärtung, zum Beispiel durch Saunieren und Anwendung von Kneippschen Güssen.[18] Psychotherapeutische Verfahren, insbesondere Methoden zur Stressbewältigung können die Immunabwehr stärken. Die klinische Hypnotherapie hat suggestive Methoden zur Unterstützung des allgemeinen Immunsystems sowie zur Behandlung einzelner Immunerkrankungen entwickelt.[19]
Sonnenlicht und Immunsystem
Sonnenlicht kann das Immunsystem stärken. Bereits vor mehr als 100 Jahren war das tägliche Sonnenbad ein fester Bestandteil der Tuberkulosetherapie (allerdings in Ermangelung von Antibiotika, die erst um 1930 entdeckt und nach 1940 am Menschen erprobt wurden). Die Forschung konnte den zugrundeliegenden Mechanismus darstellen: Bestimmte Abwehrzellen besitzen auf ihrer Oberfläche einen so genannten Toll-like Receptor; dieser wird bei einer Bakterieninfektion aktiviert und veranlasst die Abwehrzelle, eine Vorstufe von Vitamin D (25-hydroxyvitamin D) zu produzieren. Gleichzeitig bildet dieselbe Zelle verstärkt einen weiteren Rezeptortyp aus, der auf die Erkennung von Vitamin D spezialisiert ist. Das Sonnenlicht wandelt die Vitamin-D-Vorstufe in das aktive Vitamin D um, welches sich nun an den Rezeptor heftet. Dadurch wird die Abwehrzelle dazu angeregt, das antibakteriell wirkende Cathelizidin zu bilden. Der Zusammenhang erklärt auch, warum Menschen mit dunkler Haut für Infektionen wie beispielsweise die Hauttuberkulose besonders empfänglich sind: In ihrem Blut finden sich in der Regel deutlich geringere Mengen der Vitamin D-Vorstufe, wobei zusätzliche Einnahme von Vitamin D-Präparaten zur Stärkung des Immunsystems den Mangel leicht ausgleichen kann. (Belege/Quelle fehlt)
Eine Schwächung des Immunsystems kann eine Folge der immunsuppressiven Wirkung der UV-B-Strahlen sein, die die T-Zell-abhängige Immunantwort stört. Eine übermäßige UVB-Belastung der Haut fördert die Entwicklung von bösartigen Hauttumoren wie Basalzellkarzinomen und Plattenepithelkarzinomen[20] und mindert die Abwehr von Krankheitserregern wie Bakterien, Pilzen oder Viren deutlich. Auch durch Parasiten hervorgerufene Erkrankungen wie die Leishmaniose, Bilharziose oder Malaria verlaufen schwerer und länger nach UV-Exposition.[21]
Impfung
Die Impfung ist eine Methode zur Stärkung des Immunsystems und eine vorbeugende Maßnahme gegen bestimmte Infektionskrankheiten. Bei der aktiven Immunisierung, der häufigsten Form der Impfung, wird das Immunsystem zur Bildung einer Immunkompetenz angeregt, ohne die Erkrankung selbst auszulösen. Hierzu werden abgeschwächte Erreger, tote Erreger oder bestimmte typische Eiweißstoffe (Proteine) und Zuckermoleküle, also Bruchstücke des Erregers, als Impfstoffe in den Körper eingebracht. Die Reaktion des Organismus auf diese Antigene führt zur Bildung spezifischer Antikörper und Gedächtniszellen, die weiterhin im Blut und den Lymphbahnen zirkulieren, wodurch der Schutz gegen diese Antigene lange erhalten bleibt. Falls der Körper erneut mit dem Erreger in Kontakt kommt, hat er durch die Gedächtniszellen eine sehr viel effizientere und schnellere Immunantwort zur Verfügung, die die Erreger bekämpft, bevor es zu einer Erkrankung kommt.
Immunsuppression
In manchen Situationen ist eine Immunsuppression, also eine medikamentöse Hemmung oder sogar komplette Unterdrückung der Immunantwort notwendig. Dies ist zum Beispiel der Fall bei Patienten, die ein fremdes Organ als Transplantat erhalten haben. Auch bei Autoimmunerkrankungen (inklusive Erkrankungen des rheumatischen Formenkreises) und Allergien ist manchmal eine Immunsuppression notwendig. Das am längsten bekannte immunsuppressive Medikament ist Cortison, die Vorstufe des körpereigenen Hormons Cortisol. Neuere Wirkstoffe wie Tacrolimus oder Cyclosporin A sind jedoch teilweise deutlich wirksamer und/oder haben geringere Nebenwirkungen.
Das Immunsystem schädigende Faktoren
Abgesehen vom Altern gibt es weitere Faktoren, die die Funktion des Immunsystems schädigen und herabsetzen können. Dazu zählen unter anderem eine starke gesundheitliche Beeinträchtigung durch Vorschädigung wie beispielsweise bei chronischen Erkrankungen, eine medikamentöse Immunsuppression wie beispielsweise nach Organtransplantationen, Drogenmissbrauch (auch Nikotin und Alkohol), eine Mangelernährung und damit verbundene Unterversorgung auch mit Vitaminen und Spurenelementen, eine ungesunde oder unausgeglichene Ernährung,[22] die Aufnahme von Umweltgiften aus der Umgebung,[23] die Einwirkung von ionisierender Strahlung, andauernder Stress, zu wenig Schlaf, Bewegungsmangel und auch eine übermäßige Kälteeinwirkung im Sinne von längerer Auskühlung[24] oder gar Unterkühlung (Hypothermie). Im Sport kommt es nach erschöpfenden Belastungen zur vorübergehenden Beeinträchtigung der Abwehrfunktion, die als Open-Window-Phänomen bekannt ist. Eine Kombination von mehreren Faktoren kann natürlich eine verstärkte Belastung für das Immunsystem darstellen.
Auch psychologische Faktoren wie Stress beeinträchtigen das Immunsystem. Stress führt dazu, dass allgemein physiologische Prozesse heruntergefahren werden, welche in hohem Maße Energie erfordern, jedoch nicht für das kurzfristige Überleben notwendig sind. Dazu zählt auch das Immunsystem. Die immunsuppressive Wirkung von Stress wird über die Ausschüttung von Glucocorticoiden (beim Menschen insbesondere Cortisol) aus der Nebennierenrinde bedingt, welche wiederum durch Adrenocorticotropin aus dem Vorderlappen der Hypophyse angestoßen wird, welches wiederum die Produktion von Zytokinen hemmt.[25] Im Falle von chronischem Stress kommt es zu einer Einschränkung des Adaptiven Immunsystems, das seine beschützende Funktion via T- und B-Zellen ausübt.[26]
Evolution
Die komplexe Wechselbeziehung zwischen dem Wirtsorganismus und den Erregern kann unter evolutionären Gesichtspunkten als ein „Angreifer-Verteidiger-System“ angesehen werden. Durch die Abwehrmaßnahmen des Immunsystems kommt es zu einem starken Selektionsdruck, unter dessen Einfluss sich die Erreger immer besser an den (menschlichen) Organismus anpassen müssen, um weiter fortzubestehen. Gleichzeitig üben Krankheitserreger oder Parasiten einen Selektionsdruck auf das Immunsystem des Wirts aus, so kann es zu einer Koevolution von Parasit und Wirt kommen, die zu einer Symbiose führen kann. Dann können die ehemaligen Erreger den Wirt für ihre Vermehrung nutzen, ohne ihn zu schädigen. Ein Beispiel für eine solche erfolgreiche Koevolution sind die Mitochondrien, welche ehemals als körperfremder Schädling in die Zellen von Eukaryoten eindrangen und die sich im Laufe der Jahrmillionen zu einer wichtigen Zellorganelle entwickelten.[27]
Bei Infektionen mit Krankheitserregern, welche an den Menschen als ihren Reservoirwirt angepasst sind, kann eine Erkrankung – bei intaktem Immunsystem und geringer Erregerdosis – entweder überhaupt nicht ausbrechen oder einen weniger schweren Verlauf nehmen. Bei Infektionen mit an den Menschen nicht oder nur wenig angepassten Erregern hängt es von vielen Faktoren (Zustand des Immunsystems, Aggressivität der Erreger) ab, wie schwer eine Erkrankung verläuft und wie lange sie dauert oder ob der Erkrankte an den Folgen der Infektion sogar verstirbt. Die Höhe der durchschnittlichen Letalität einer Erkrankung lässt nach dieser Theorie beispielsweise Rückschlüsse zu, wie gut oder schlecht Krankheitserreger an den Menschen angepasst sind.
Durch diese evolutionäre Betrachtungsweise lassen sich viele Vorgänge der Immunologie besser verstehen und interessante Erkenntnisse zur Stammesgeschichte der Erreger gewinnen. In vielen wissenschaftlichen Studien wurden Hinweise für die Richtigkeit dieser Betrachtungsweise gefunden, es gibt jedoch auch noch genauso viele widersprüchliche Ergebnisse, so dass diese evolutionäre Theorie der Immunologie noch nicht abschließend bewertet werden kann.
Einfluss auf die Partnerwahl
Untersuchungen mit Tieren am Max-Planck-Institut für Immunbiologie erbrachten unter anderem Hinweise auf einen Zusammenhang zwischen dem individuellen Immunsystem eines Lebewesens und der Partnerwahl. Über den Geruchssinn kann die genetische Individualität und Verschiedenheit erfasst und bewertet werden. Die Untersuchungen ergaben: MHC-Peptide erlauben dem Immunsystem, durch die Analyse der MHC-Peptidkomplexe an der Zelloberfläche durch die T-Zellrezeptoren Information über den Status von einzelnen Zellen zu erlangen. Und die Analyse der Struktur dieser Peptide ermöglicht über olfaktorische Neuronen Informationen über den genetischen Status eines Gegenübers zu gewinnen. Dies ist möglich, weil die Struktur der Ankerreste von Peptiden Rückschlüsse auf die Struktur von MHC-Molekülen und damit Rückschlüsse auf die Kodierungskapazität von Organismen erlauben.[28]
Literatur
- Charles A. Janeway: Immunologie. Spektrum Akademischer Verlag; 5. Auflage (2002) ISBN 3-8274-1079-7.
- Gerd-Rüdiger Burmester: Taschenatlas der Immunologie. Grundlagen, Labor, Klinik. Thieme, Stuttgart; 2. Auflage (2006) ISBN 3-13-115382-2
- Abul K. Abbas: Cellular and Molecular Immunology (engl.). W.B. Saunders Company; 5th Update (2005) ISBN 1-4160-2389-5
- Peter F. Zipfel, Peter Kraiczy, Jens Hellwage: Wie Mikroorganismen der Immunabwehr entgehen – Das tägliche Versteckspiel. Biologie in unserer Zeit 32(6), S. 371–379 (2002), ISSN 0045-205X
Weblinks
- Das Immunsystem – graphische Darstellung im PDF-Format (1,44 MB)
- Deutsche Gesellschaft für Immunologie (DGfI)
- Artikel über Ursachen von Autoimmunerkrankungen/Hygienehypothese
| Dieser Artikel wurde am 28. September 2006 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |
Einzelnachweise
- ↑ Borghans JA, Noest AJ, De Boer RJ: How Specific Should Immunological Memory Be?. In: The Journal of Immunology. Nr. 163, 1999, S. 569-575 (Online).
- ↑ S. Al-Attar, E. R. Westra u. a.: Clustered regularly interspaced short palindromic repeats (CRISPRs): the hallmark of an ingenious antiviral defense mechanism in prokaryotes. In: Biological Chemistry. Band 392, Nummer 4, April 2011, S. 277–289, ISSN 1437-4315. doi:10.1515/BC.2011.042. PMID 21294681. (Review).
- ↑ M. P. Terns, R. M. Terns: CRISPR-based adaptive immune systems. In: Current opinion in microbiology. Band 14, Nummer 3, Juni 2011, S. 321–327, ISSN 1879-0364. doi:10.1016/j.mib.2011.03.005. PMID 21531607. PMC 3119747 (freier Volltext). (Review).
- ↑ L. A. Marraffini, E. J. Sontheimer: CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. In: Nature Reviews Genetics. Band 11, Nummer 3, März 2010, S. 181–190, ISSN 1471-0064. doi:10.1038/nrg2749. PMID 20125085. PMC 2928866 (freier Volltext). (Review).
- ↑ Svedmyr E, Jondal M: Cytotoxic effector cells specific for B Cell lines transformed by Epstein-Barr virus are present in patients with infectious mononucleosis.. In: Proc Natl Acad Sci USA.. Nr. 72(4), 1975, S. 1622-1626 (Lang, Kurz).
- ↑ Ljunggren HG, Karre K: In search of the 'missing self': MHC molecules and NK cell recognition.. In: Immunol Today.. Nr. 11(7), 1990, S. 237-244, PMID 2201309.
- ↑ Banchereau, J. and Steinman R. M..: Dendritic cells and the control of immunity. In: Nature. 392, Nr. 6673, 1998, S. 245-252. PMID 9521319.
- ↑ Henning Engeln: Das große Fressen, in GEO kompakt Nr. 2, März 2005, Seite 132-140 ISSN 1614-6913
- ↑ M. Lucas, W. Schachterle, K. Oberle, P. Aichele, A. Diefenbach: Dendritic cells prime natural killer cells by trans-presenting interleukin 15. In: Immunity. Band 26, Nummer 4, April 2007, ISSN 1074-7613, S. 503–517, doi:10.1016/j.immuni.2007.03.006, PMID 17398124, PMC 2084390 (freier Volltext).
- ↑ Sakaguchi S, Sakaguchi N et al.: Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. In: J Immunol.. Nr. 155(3), 1995, S. 1151-1164, PMID 7636184.
- ↑ Campanelli R, Palermo B et al.: Human CD8 co-receptor is strictly involved in MHC-peptide tetramer-TCR binding and T cell activation. In: Int Immunol.. Nr. 14(1), 2002, S. 39-44 (ArtikelAbstract).
- ↑ June CH, Ledbetter JA et al.: Role of the CD28 receptor in T-cell activation. In: Immunol Today. Nr. 11(6), 1990, S. 211-216, PMID 2162180.
- ↑ Bubanovic I, Najman S: „Failure of anti-tumor immunity in mammals--evolution of the hypothesis“ Acta Biotheor. 2004;52(1): s. 57-64. PMID 14963404
- ↑ Klein MA, Frigg R et al.: A crucial role for B cells in neuroinvasive scrapie. In: Nature. Nr. 390(6661), 1997, S. 687-690, PMID 9414161 (Artikel).
- ↑ Irwin M, Mascovich A et al.: Partial sleep deprivation reduces natural killer cell activity in humans. In: Psychosomatic Medicine. Nr. 56(6), 1994, S. 493-498 (Abstract).
- ↑ Schedlowski M, Schmidt RE: Streß und Immunsystem. In: Naturwissenschaften. Nr. 83(5), 1996, S. 214-220, PMID 8668232.
- ↑ Gmünder, Felix K., Sport und Immunologie, Vorlesung an der ETH Zürich (PowerPoint Presentation)
- ↑ Dugue B, Leppanen E: Adaptation related to cytokines in man: effects of regular swimming in ice-cold water. In: Clinical Physiology. Nr. Volume 20(2), 2000, S. 114–121 (Artikel).
- ↑ Auerbach J Suggestions with Autoimmune Disease, in: D. Corydon Hammond (Hrsg.), Handbook of Hypnotic Suggestions and Metaphors, New York, London (Norton) 1990, 241f.
- ↑ [1]UV Strahlung und Hautkrebs, Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung IPA 2011, abgerufen am 12.März 2014
- ↑ [2]Urlaubsattacken auf das Immunsystem, Pharmazeutische Zeitung online 2005, abgerufen am 12.März 2014
- ↑ Forschungsnachrichten.de: Mit Aminosäuren der Erkältung den Kampf ansagen (29. September 2005)
- ↑ L. Bayer-Oglesby, L. Grize, M. Gassner, K. Takken-Sahli, F. H. Sennhauser, U. Neu, C. Schindler, C. Braun-Fahrländer: Decline of ambient air pollution levels and improved respiratory health in Swiss children. In: Environmental health perspectives. Band 113, Nummer 11, November 2005, S. 1632–1637, ISSN 0091-6765. PMID 16263523. PMC 1310930 (freier Volltext).
- ↑ Johnson C, Eccles R: Acute cooling of the feet and the onset of common cold symptoms. In: Family Practice. Nr. 22(6), 2005, S. 608-613 (Abstract).
- ↑ Manfred Schedlowski, Uwe Tewes: Psychoneuroimmunologie. Spektrum Akademischer Verlag, 1996, ISBN 3-86025-228-3
- ↑ John P.J. Pinel, Biopsychology, Pearson Education 2009
- ↑ Dyall SD, Brown MT, Johnson PJ: Ancient invasions: from endosymbionts to organelles. In: Science. Nr. 304(5668), 2004, S. 253-257, PMID 15073369.
- ↑ Boehm, Thomas 2005 Qualitätskontrolle im Immunsystem. (Steuerung der Partnerwahl) Max-Planck-Institut für Immunbiologie, Freiburg, Beteiligte Abteilungen: Entwicklung des Immunsystems
| Dieser Artikel basiert ursprünglich auf dem Artikel Immunsystem aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |