| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Epigenetik
Die Epigenetik (altgr. ἐπί epi ‚dazu‘, ‚außerdem‘ und Genetik) ist das Fachgebiet der Biologie, welches sich mit der Frage befasst, welche Faktoren die Aktivität eines Gens und damit die Entwicklung der Zelle zeitweilig festlegen. Sie untersucht die Änderungen der Genfunktion, die nicht auf Mutation oder Rekombination beruhen und dennoch an Tochterzellen weitergegeben werden.
Grundlage sind Veränderungen an den Chromosomen im laufenden Lebenszyklus, wodurch Abschnitte oder ganze Chromosomen in ihrer Aktivität beeinflusst werden. Man spricht auch von epigenetischer Veränderung bzw. epigenetischer Prägung.[1] Die DNA-Sequenz wird dabei jedoch nicht verändert. Die Veränderungen können in einer DNA-Methylierung, in einer Modifikation der Histone oder im beschleunigten Abbau von Telomeren bestehen. Diese Veränderungen lassen sich im Phänotyp, aber nicht im Genotyp (DNA-Sequenz) beobachten.[2]
Einführung

Bei der Vererbung wird Erbgut weitergegeben. Epigenetische Fixierung bewirkt, dass die totipotenten Zellen reifen und sich spezialisieren. Der Reifungsprozess ist normalerweise nicht umkehrbar. (Jeder Pfeil deutet eine Zellteilung an. Dabei wird die Zelle verändert. Diese Veränderungen werden mit dem Erbgut an die Tochterzellen weitergegeben. Es handelt sich dabei nicht um Sequenzveränderungen der DNA.)
Nach der Befruchtung teilt sich die Eizelle. Bis zum 8-Zell-Stadium sind alle Tochterzellen gleichwertig. Man bezeichnet sie als totipotent, weil jede von ihnen noch alleine in der Lage ist, einen kompletten Organismus hervorzubringen. Danach finden sich Zellen mit einem unterschiedlichen inneren Programm, deren Entwicklungspotenzial von nun an eingeschränkt – d. h. mehr und mehr spezialisiert – wird. Wenn der Körper fertig ausgebildet ist, sind die meisten Körperzellen für ihre Funktion fest programmiert (lediglich die sogenannten adulten Stammzellen bewahren sich eine gewisse Flexibilität). Dabei bleibt die Sequenz des Erbgutes unverändert (abgesehen von wenigen zufälligen, genetischen Veränderungen = Mutationen). Die funktionelle Festlegung erfolgt durch verschiedene Mechanismen, einer davon beruht auf biochemischen Modifikationen an einzelnen Basen der Sequenz oder der die DNA verpackenden Histone oder beiden. Solche Veränderungen führen dazu, dass bestimmte Bereiche des Erbgutes „stillgelegt“, andere dafür leichter transkribiert (in RNA für Proteine umgeschrieben) werden können. Diese Modifizierungen sehen in Körperzellen ganz anders aus als in Stammzellen oder in Keimzellen (Eizellen und Spermien; auch Krebszellen haben meist abweichende [und dabei spezifische] Modifikationsmuster). Die wichtigsten Modifikationen sind die Methylierung von Cytidin-Basen in Cytosin-Guanosin-Nukleotid-Dimeren (CpG) (DNA-Methylierung) sowie die Seitenketten-Methylierung und -Acetylierung von Histonen.
Neben Methylierung haben Telomere eine wichtige epigenetische Bedeutung. Telomere schützen die Enden der Chromosomen bei der Zellteilung vor dem Abbau. Das Enzym Telomerase stellt dabei sicher, dass die Chromosomen intakt bleiben. Psychische Belastung kann die Aktivität dieses Enzyms verringern, was zu einer beschleunigten Verkürzung der Telomere im Alterungsprozess führen kann (Nobelpreis für Medizin 2009 an Elizabeth Blackburn).
Begriff
Epigenetisch sind alle Prozesse in einer Zelle, die als „zusätzlich“ zu den Inhalten und Vorgängen der Genetik gelten. Conrad Hal Waddington hat den Begriff Epigenetik erstmals benutzt. Im Jahr 1942 (als die Struktur der DNA noch unbekannt war) definierte er Epigenetik als the branch of biology which studies the causal interactions between genes and their products which bring the phenotype into being („der Zweig der Biologie, der die kausalen Wechselwirkungen zwischen Genen und ihren Produkten, die den Phänotyp hervorbringen, untersucht“). Zur Abgrenzung vom allgemeineren Konzept der Genregulation sind heutige Definitionen meist spezieller, zum Beispiel: „Der Begriff Epigenetik definiert alle meiotisch und mitotisch vererbbaren Veränderungen in der Genexpression, die nicht in der DNA-Sequenz selbst codiert sind.“[3] Andere Definitionen, wie die von Adrian Peter Bird, einem der Pioniere der Epigenetik, vermeiden die Einschränkung auf generationsübergreifende Weitergabe. Epigenetik beschreibe „die strukturelle Anpassung chromosomaler Regionen, um veränderte Zustände der Aktivierung zu kodieren, zu signalisieren, oder zu konservieren.“[4] In einer Überblicksarbeit zum Thema Epigenetik bei Bakterien wurde von Casadesús und Low vorgeschlagen, eine vorläufige Definition zu benutzen, solange es keine allgemein akzeptierte Definition der Epigenetik gibt: „Eine vorläufige Definition könnte jedoch sein, dass die Epigenetik die Untersuchung der Zelllinienbildung durch nicht-mutationale Mechanismen anspricht.“[5]
Epigenese
Mit dem Ausdruck Epigenese werden die graduellen Prozesse der embryonalen Morphogenese von Organen beschrieben. Diese beruhen auf Mechanismen auf der Ebene von Zellen und Zellverbänden, das sind Turing-Mechanismen oder allgemein Musterbildungsprozesse in der Biologie. Beispiele hierfür findet man etwa bei der Erklärung der embryonalen Extremitätenentwicklung der Wirbeltiere.
Zugehörige Begriffe
Zu den epigenetischen Prozessen zählt man die Paramutation, das Bookmarking, das Imprinting, das Gen-Silencing, die X-Inaktivierung, den Positionseffekt, die Reprogrammierung, die Transvection, maternale Effekte (paternale Effekte sind selten, da wesentlich weniger nicht-genetisches Material mit dem Spermium „vererbt“ wird), den Prozess der Karzinogenese, viele Effekte von teratogenen Substanzen, die Regulation von Histonmodifikationen und Heterochromatin sowie technische Limitierungen beim Klonen.
Epigenetik im Vergleich zur Genetik
Man kann den Begriff Epigenetik verstehen, wenn man sich den Vorgang der Vererbung vor Augen führt:
- Vor einer Zellteilung wird die Erbsubstanz verdoppelt. Jeweils die Hälfte des verdoppelten Genoms wird dann auf eine der beiden Tochterzellen übertragen. Bei der sexuellen Vermehrung des Menschen, der Fortpflanzung, werden von der Eizelle die Hälfte des mütterlichen Erbguts und vom Spermium die Hälfte des väterlichen Erbguts miteinander vereint.
- Die Molekulargenetik beschreibt die Erbsubstanz als Doppelhelix aus zwei Desoxyribonukleinsäure-Strängen, deren Rückgrat aus je einem Phosphat-Desoxyribosezucker-Polymer besteht. Die genetische Information ist durch die Reihenfolge der vier Basen Adenin (A), Cytosin (C), Guanin (G) und Thymin (T) bestimmt, die jeweils an einen der Desoxyribose-Zucker angehängt sind.
- Die Basen des einen Stranges paaren sich fast immer mit einer passenden Base des zweiten Stranges. Adenin paart sich mit Thymin, und Cytosin paart sich mit Guanin.
- In der Reihenfolge der Bausteine A, C, G, T (der Basensequenz) ist die genetische Information verankert.
Einige Phänomene der Vererbung lassen sich nicht mit dem gerade beschriebenen DNA-Modell erklären:
- Bei der Zelldifferenzierung entstehen im Verlauf von Zellteilungen Tochterzellen mit anderer Funktion, obwohl das Erbgut in allen Zellen gleich ist. Die Festlegung der funktionellen Identität einer Zelle ist ein Thema der Epigenetik.
- Es gibt Eigenschaften, die nur vom Vater her (paternal) „vererbt“ werden, so wie es Eigenschaften gibt, die nur von der Mutter (maternal) stammen und die nicht mit der Basensequenz in Zusammenhang stehen. Störungen dieses Zustandes führen zu schweren Krankheiten.
- Bei der Rückumwandlung von funktionell festgelegten Zellen (terminal differenzierte Zellen) in undifferenzierte Zellen, die sich wieder in verschiedene Zellen entwickeln können und die bei der Klonierung von Individuen (z. B. von Dolly) eingesetzt werden, müssen epigenetische Fixierungen aufgehoben werden, damit eine Zelle nicht auf eine einzige Funktion festgelegt bleibt, sondern wieder alle oder viele Funktionen erwerben und vererben kann.

Die DNA ist um den Kern aus acht Histon-Untereinheiten (je zwei H2a, H2b, H3 und H4) gewickelt und macht etwa 1,7 Umdrehungen. An das Stück DNA zwischen zwei Nukleosomen bindet Histon 1 (H1). Die Enden der Histone sind für epigenetische Modifizierung verfügbar: Methylierung, Acetylierung oder Phosphorylierung. Dadurch wird die Verdichtung oder Ausdehnung des Chromatins beeinflusst.[6]
Histone und ihre Rolle bei der epigenetischen Fixierung
DNA liegt im Zellkern nicht nackt vor, sondern ist an Histone gebunden. Acht verschiedene Histonproteine, jeweils zwei Moleküle von Histon 2A, Histon 2B, Histon 3 und Histon 4 bilden den Kern eines Nukleosoms, auf das 146 Basenpaare eines DNA-Stranges aufgespult sind. Die Enden der Histonstränge ragen aus dem Nukleosom heraus und sind Ziel von Histon-modifizierenden Enzymen. Vor allem Methylierungen und Acetylierungen an Lysin, Histidin oder Arginin, außerdem Phosphorylierungen an Serinen sind die bekannten Modifizierungen. Außerdem spielt es eine Rolle, ob die Lysin-Seitenkette mit ein, zwei oder drei Methyl-Gruppen belegt ist. Durch vergleichende Analyse postuliert man eine Art von „Histon-Code“, der in direktem Zusammenhang mit der Aktivität des von den Histonen jeweils gebundenen Gens stehen soll.
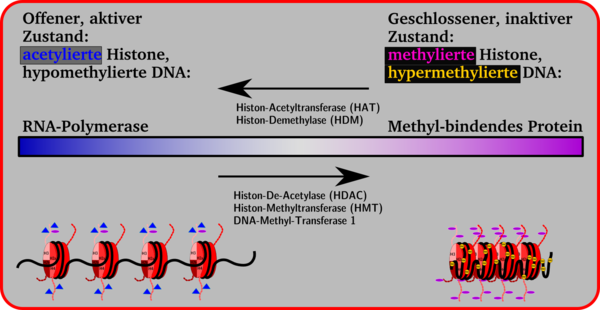
Die Histonseitenketten in den Nukleosomen können enzymatisch verändert werden. Dadurch ändert sich das Volumen eines Gensegments. Kleinere Volumina, geschlossene Konformation, Chromosomkondensierung und Inaktivität eines Gens stehen auf der einen Seite, größere Volumina, offene Konformation und Gen-Aktivität auf der anderen. Zwischen beiden Seiten ist ein Übergang möglich, der durch Anheftung und Abspaltung von Methylgruppen an Cytidin-Basen, durch Methylierung, Demethylierung, Acetylierung oder Deacetylierung mit Hilfe von Enzymen bewirkt wird.
Generell kann man sagen, dass die Anheftung von Acetyl-Gruppen an die Lysin-Seitenketten der Histone zur Öffnung der Nukleosomen-Konformation führt, wodurch das Gen für die Transkription durch die RNA-Polymerase verfügbar wird. Durch eine verstärkte Anheftung von Methyl-Gruppen an Lysin-Seitenketten werden Proteine angeheftet wie z. B. das Methyl-bindende Protein MeCB, die die Genexpression unterdrücken, reprimieren, daher auch Repressorproteine genannt, wodurch die Histon-Konformation geschlossen wird und keine Transkription möglich ist.
Methoden der epigenetischen Forschung
Restriktionsendonukleasen, die nur an demethylierten CG-Dimeren schneiden
HpaII (Die zweite Restriktionsendonuklease aus Haemophilus parainfluenza) schneidet CCGG-Palindrome nur, wenn die CG-Dimere nicht methyliert sind, im Vergleich zu BsiSI (aus Bacillus), die auch methylierte CmeCGG-Palindrome schneidet. Tryndiak und Mitarbeiter zeigen damit, dass bei Zellen auf dem Weg zum Mammakarzinom ein fortschreitender globaler Verlust von DNA-Methylierung mit einer fehlgeleiteten Bildung der DNMT1, meCG-bindender Proteine und Veränderungen in den Histonen einhergeht.[7]
Bisulfit-Sequenzierung
Durch Behandlung von DNA mit Natriumhydrogensulfit (alter Name „Bisulfit“) wird Cytosin (C) in Uracil (U) umgewandelt. Bei einer anschließenden Sequenzierung findet man daher an den Stellen, wo vorher ein C war, nun ein U/T. Da bisulfit-behandelte DNA sehr labil ist, wird daher das Gen, das man analysieren möchte, mittels PCR wieder amplifiziert. Bei der nachfolgenden Sequenzierung werden dann T bzw. TG (Thymin-Guanosin-Dimere) identifiziert, wo in der unbehandelten DNA Cytosin bzw. CG-Dimere existierten.
Für die epigenetische Analyse ist wichtig, dass nur nicht-methylierte C-Basen konvertiert werden, während meC in CG-Dimeren nicht in Thymin konvertiert werden. Man kann daher mit dieser Methode exakt analysieren, welche CG-Dimere in einer bestimmten Zelle methyliert waren. Indem man das bisulfit-behandelte Genstück, das man analysieren möchte, nach der PCR-Amplifikation kloniert und verschiedene Klone sequenziert, erhält man eine Abschätzung, ob ein bestimmtes CG-Dimer gar nicht, vollständig oder nur partiell methyliert war. Bei der Methode des Pyrosequencing ist dieses Verfahren noch verfeinert und erlaubt genauere quantitative Aussagen: Man kann zum Beispiel den Schweregrad einer Tumorentartung mit dem Methylierungsgrad von CG-Inseln einzelner sogenannter Tumor-Suppressorproteine vergleichen und stellt fest, dass in bestimmten Tumoren des blutbildenden System (Hämatopoietisches System) bestimmte meCG-Dimere mit steigenden Schweregrad immer stärker methyliert sind.
Chromatin-Immunpräzipitation
Bei dieser Methode kann man bestimmen, ob ein bestimmtes Protein an ein gegebenes DNA-Stück bindet: Durch Behandlung der Zellen oder biologischen Gewebes mit Formaldehyd werden die bindenden Proteine mit der DNA kovalent verknüpft. Die aus den Zellen extrahierte DNA wird anschließend durch Behandlung mit Ultraschall in Bruchstücke von 50 bis 1000 Basenpaare fragmentiert, an denen die gebundenen Proteinen verbleiben. In einem nächsten Schritt wird mit einem Antikörper das interessierende Proteine zusammen mit den daran gebundenen DNA Fragmenten extrahiert, und anschließend die kovalente Bindung zwischen Protein und DNA durch Hitzebehandlung in 300 mM Kochsalz-Lösung wieder aufgelöst. Die damit abgetrennten DNA Fragmente können anschließend identifiziert bzw. quantifiziert werden (mittels Gen-spezifischer PCR oder Genom-weiter NGS). Aus der Häufigkeit, mit der dabei ein bestimmtes DNA Fragment identifiziert wird, lässt sich schlussfolgern, ob bzw. wie stark das Protein in der lebenden Zelle mit dem betreffenden DNA-Abschnitt assoziiert war. Je nach dem, welches Protein man mit Antikörpern versucht zu präzipitieren, kann man z. B. sagen:
- Die RNA-Polymerase hat an dem Gen gebunden, daher wurde es transkribiert, das Gen war aktiv.
- Das meCG-bindende Protein (MeCP) war an das Gen gebunden, daher wurde dieses nicht transkribiert und war ruhiggestellt (engl. silencing).
Electrophoretic Mobility Shift Assay
Die unterschiedlichen DNA-Moleküle weisen unterschiedliche Laufverhalten in einer Gelelektrophorese auf.
Epigenomik und Methoden der epigenetischen Forschung
Epigenomik (engl. Epigenomics) oder Epigenomforschung ist ein Teilgebiet der Epigenetik, das auf die Untersuchung des möglichst vollständigen Satzes epigenetischer Modifikationen am genetischen Material einer Zelle zielt. Solche zusammenhängenden Sätze von epigenetischen Modifikationen werden Epigenome genannt.
Der Begriff Epigenomics wurde analog zu anderen -omics, wie Genomics und Proteomics gebildet und wurde populär, als Methoden zur Verfügung standen, epigenetische Modifikationen im größeren Stil zu untersuchen. Die Initiierung des Human Epigenome Project im Jahr 1999 hat dazu einen wesentlichen Beitrag geleistet.[8][9]
Epigenomik und Epigenetik schließen sich nicht aus. Die umfassende und effiziente Erforschung der Epigenetik auf globaler Ebene wird durch Hochdurchsatz-Methoden ermöglicht. Die Verwendung des Begriffs Epigenomforschung bzw. Epigenomik kennzeichnet diese Vorgehensweise spezifischer als die Verwendung des Begriffs Epigenetik.
Zwei der am meisten charakterisierten epigenetischen Markierungen sind DNA-Methylierungen und Histonmodifikationen. Eine Gesamtbestimmung von DNA-Methylierungen zu einer bestimmten Zeit, in einem bestimmten Gewebe usw. wird häufig als Methylom oder DNA-Methylierungsmuster bezeichnet, ein zusammenhängender Satz von Histonmodifikationen wird häufig Histon-Code genannt. Sowohl Methylome (bzw. DNA-Methylierungsmuster) als auch Histon-Codes sind Teil-Epigenome.
Beispielhaft seien hier für die Untersuchung von Epigenomen die Bisulfit-Sequenzierung und ChIP-Seq genannt. Die Bisulfit-Sequenzierung ermöglicht eine umfassende Analyse von "Methylomen" (DNA-Methylierungsmustern) und ChIP-Seq kann für die Interaktion von Histonen mit der DNA eingesetzt werden.
Es ist anzumerken, dass die Epigenomforschung zwar als Teilgebiet der Epigenetik angesehen werden kann, jedoch ein sehr interdisziplinäres Fach ist, das beispielsweise Schnittmengen mit der Genetik, der Molekularbiologie allen -omik-Gebieten, der Systembiologie und der Bioinformatik aufweist.[10]
Epigenetische Veränderungen im Lebenslauf
Epigenetik beschränkt sich nicht auf Vererbungsfälle. Zunehmende Beachtung finden epigenetische Forschungsergebnisse im Zusammenhang mit anhaltenden Veränderungen im Lebenslauf sowie im Zusammenhang mit der Ausbildung von Krankheiten. So konnte an 80 eineiigen Zwillingen nachgewiesen werden, dass sie im Alter von drei Jahren epigenetisch noch in hohem Maß übereinstimmen, nicht mehr aber im Alter von 50 Jahren, wenn sie wenig Lebenszeit miteinander verbrachten und/oder eine unterschiedliche medizinisch-gesundheitliche Geschichte hinter sich haben. So war der Methylierungsgrad bis zu zweieinhalb mal höher bei einem Zwilling, sowohl in absoluten Zahlen als auch was die Verteilung der epigenetischen Marker angeht. Ältere Zwillinge sind demnach trotz ihrer genetischen Identität epigenetisch umso verschiedener, je unterschiedlicher das Leben der Zwillinge verläuft. Der Grund liegt neben der erlebten Umwelt auch in der Ungenauigkeit bei der Übertragung von Methylgruppenmustern bei jeder Zellteilung. Schleichende Veränderungen summieren sich damit im Lauf eines Lebens immer stärker auf.[11]
Die Umstellung der Ernährung bei Arbeiterbienen nach Ablauf der ersten Wochen des Larvenstadiums auf eine einfache Pollen- und Honigkost im Vergleich zur Königin verursacht eine hochgradige epigenetische Umprogrammierung des Larvengenoms. Mehr als 500 Gene wurden identifiziert, die von den umweltspezifisch verursachten Methylierungsveränderungen betroffen sind. Nicht nur Aktivierung bzw. Nichtaktivierung von Genen ist die Folge des Ernährungswandels, sondern sogar alternatives Splicing und veränderte Genprodukte.[12]
Epigenetische Veränderungen als Erklärung von Krankheiten
Die Erklärung von Stressfaktoren bildet einen Schwerpunkt der epigenetischen Forschung. Individuen mit frühen traumatischen Lebenserfahrungen, zum Beispiel ausgelöst durch mangelnde Mutterschaftsfürsorge von Rattenmüttern, wurden dafür herangezogen. Stress setzt eine Kaskade von Hormonausschüttungen zu seiner Kontrollierung in Gang, deren Kette im Hypothalamus, einem Teil des Zwischenhirns beginnt. Nachgewiesen werden konnte, dass ein Glucocorticoid-Gen bei den betreffenden Individuen auffallend unterschiedliche Methylierungen aufweist. Entsprechend ist das Gen bei Vorliegen von Stressvergangenheit gehemmt. Das Genprodukt in der Nebennierenrinde als Endstation der Hormonkette ist in der Folge unterschiedlich.[13][14][15] Mehr als 900 Gene werden im Gehirn als Folge mütterlicher Verhaltensweisen herauf- oder herunterreguliert.
Die Ergebnisse konnten bei Menschen ebenfalls bestätigt werden. Das Rezeptorgen im Hippocampus stimmt beim Mensch mit dem anderer Säugetiere weitgehend überein. Epigenetische Veränderungen sind daher ähnlich wie bei den Ratten. Eine Studie mit Suizidkandidaten teilte Betroffene in zwei Gruppen auf, solche mit Missbrauchserfahrungen in der Kindheit und solche ohne. Nur bei den Kandidaten mit Missbrauchsvergangenheit war das Rezeptorgen mit Methylierung blockiert.[16] Ein Trauma, das die Mutter in der Schwangerschaft erlebt, kann nach demselben epigenetischen Muster sogar anhaltende Folgen für das werdende Kind nach sich ziehen, die für das Kind jahrzehntelang bestehen bleiben.[17] In einer Studie aus den Niederlanden wurde gezeigt, dass Kinder von Müttern, die sehr früh während der Schwangerschaft unter einer Hungersnot litten, im Verlaufe ihres Lebens ein deutlich erhöhtes Risiko für Schizophrenie[18] und Herz-Kreislauf-Erkrankungen[19] zeigten und gleichzeitig Änderungen im Methylierungsmuster des Igf2 Genes trugen[20].
Bei Mäusen führt regelmäßige Kokaingabe zu einem veränderten Muster epigenetischer Marker von einigen hundert Genen im Belohnungszentrum des Gehirns. Dies erhöht die Empfindlichkeit für die Drogenwirkung und steigert die Suchtgefahr.[21]
Die Größenordnung epigenetischer Veränderungen ist im Lebensverlauf um ein Vielfaches höher als die genetischer Mutationen. Die Wissenschaft erwartet daher künftige weitere neue Antworten auf eine Vielzahl von Krankheiten im alternden Organismus, die genetisch heute nicht erklärbar sind, darunter Schizophrenie, Alzheimer-Krankheit, Krebs, Altersdiabetes, Nervenkrankheiten und andere.[22]
„Vererbung“ epigenetischer Prägungen?
Von den Befunden zu epigenetischen Veränderungen werden vor allem in der Populärwissenschaft immer wieder Parallelen zum Lamarckismus gezogen und ein Widerspruch zur klassischen Genetik gesehen. Bisher existieren allerdings nur sehr wenige Hinweise, dass erlernte und erworbene Fähigkeiten von einer Generation zur anderen über die Keimzellen weitergegeben werden können.[23] Auch ist eine Weitergabe an die nachfolgende Generation noch kein Beweis für eine genetische Manifestation, auch wird häufig der Begriff „Generation“ als Beginn eines Individualzyklus falsch interpretiert.
Eine Vererbung epigenetischer Prägungen wurde 2003 von Randy Jirtle und Robert Waterland mittels Mäuseexperimenten vorgeschlagen.[24][25] Weiblichen Agoutimäusen wurde vor der Paarung und während der Schwangerschaft eine bestimmte Zusammensetzung an Nährstoffen verabreicht. Es zeigte sich, dass ein Großteil der Nachkommen nicht den typischen Phänotyp aufweist.
In einer Humanstudie untersuchten die beiden Genetiker Marcus Pembrey und Lars Olov Bygren sowie Mitarbeiter verschiedene Faktoren, die Aufschluss über die Lebensmittelverfügbarkeit und Sterbefälle der kleinen schwedischen Stadt Överkalix gaben.[26] Es zeigte sich, dass die meisten Personen, deren Großeltern in ihrer Kindheit genug zu essen hatten, mit zunehmendem Alter an Diabetes erkrankten.[27] Die Erkrankung trat allerdings nach einem bestimmten Muster auf, was auf epigenetische Veränderungen auf den Geschlechtschromosomen schließen lässt. Zum Beispiel waren bei Familien, in denen sich der Großvater gut bzw. übermässig ernährt hatte, von allen Enkelkindern nur die männlichen Enkel betroffen.
Nach einer Hypothese von William R. Rice, Urban Friberg und Sergey Gavrilets aus dem Jahr 2012 könnte die Entstehung der menschlichen Homosexualität durch epigenetische „Vererbung“ verursacht sein. So würde bei einigen Individuen die sexuelle Präferenz der Mutter an den Sohn und die Präferenz des Vaters auf die Tochter übertragen. Das passiere dann, wenn die epigenetischen DNA-Markierungen (engl. "Epi-Marks") bei Genen, die für die sexuelle Ausrichtung verantwortlich sind, in den Keimzellen erhalten blieben. Wenn beispielsweise diese epigenetischen DNA-Markierungen in der unbefruchteten Eizelle (also der mütterlichen Keimzelle) nicht vollständig zurück gesetzt wird, könnte dann ein Embryo zwar männliche Geschlechtsorgane ausbilden (wenn er den XY-Genotyp geerbt hat), die sexuelle Ausrichtung auf das männliche Geschlecht wäre aber ähnlich wie bei der Mutter. Die Homosexualität des Menschen ist nach dieser Hypothese angeboren. Die Hypothese erklärt, weshalb das Vorkommen von Homosexualität beim Menschen über die Zeit statistisch stabil bleibt. Allerdings schreiben die Autoren um Rice auch, dass es sich lediglich um eine Hypothese handele, es hingegen bislang keine empirischen Hinweise für einen Zusammenhang zwischen Homosexualität und Epigenetik gebe.[28][29] Eine kritische Analyse der Hypothese von Rice et al. hat Heinz J. Voss vorgenommen.[29]
Epigenetik bei Bakterien
Während die Epigenetik bei Eukaryoten, insbesondere bei den vielzelligen Tieren (Metazoa), von grundlegender Bedeutung ist, spielt sie bei Bakterien eine andere Rolle. Am wichtigsten ist dabei, dass Eukaryoten epigenetische Mechanismen in erster Linie zur Regulierung der Genexpression verwenden, was die Bakterien selten tun. Allerdings ist die Nutzung der postreplikativen DNA-Methylierung für die epigenetische Kontrolle von DNA-Protein-Wechselwirkungen bei Bakterien weit verbreitet. Außerdem verwenden Bakterien DNA-Adenin-Methylierung (anstelle von DNA-Cytosin-Methylierung) als epigenetisches Signal. DNA-Adenin-Methylierung ist bei Bakterienvirulenz in Organismen wie Escherichia coli, Salmonella, Vibrio, Yersinia, Haemophilus und Brucella wichtig. In den Alphaproteobakterien reguliert die Methylierung von Adenin den Zellzyklus und verbindet die Gentranskription mit der DNA-Replikation. In Gammaproteobakterien liefert die Adeninmethylierung Signale für die DNA-Replikation, Chromosomensegregation, Fehlpaarungsreparatur, Verpackung von Bakteriophagen, Transposaseaktivität und Regulation der Genexpression.[30][31] Es gibt einen genetischen Schalter, der Streptococcus pneumoniae (Pneumokokken) kontrolliert und es dem Bakterium erlaubt, seine Eigenschaften zufällig so zu ändern, dass einer von sechs alternativen Zuständen eintritt. Das könnte den Weg zu verbesserten Impfstoffen ebnen. Jede Form wird zufällig durch ein phasenvariables Methylierungssystem erzeugt. Die Fähigkeit der Pneumokokken, tödliche Infektionen zu verursachen, ist in jedem dieser sechs Zustände unterschiedlich. Ähnliche Systeme existieren in anderen Bakteriengattungen.[32]
Literatur
Übersichtsartikel
- Bradbury, J. (2003): Human Epigenome Project—Up and Running. In: PLoS Biol. Bd. 1, S. e82 doi:10.1371/journal.pbio.0000082; PDF (freier Volltextzugriff, engl.).
- Costa, FF. (2008): Non-coding RNAs, epigenetics and complexity. In: Gene Bd. 410, Nr. 1, S. 9–17, PMID 18226475, doi:10.1016/j.gene.2007.12.008.
- Jablonka, E. und Lamb, MJ. (2002): The Changing Concept of Epigenetics. In: Annals of the New York Academy of Sciences Bd. 981, S. 82–96, PMID 12547675.
- Delcuve, GP. et al. (2009): Epigenetic control. In: J Cell Physiol. Bd. 219, Nr. 2, S. 243–250, PMID 19127539, PDF (freier Volltextzugriff, engl.)
- Marmorstein, R. und Trievel, RC. (2009): Histone modifying enzymes: structures, mechanisms, and specificities. In: Biochimica et Biophysica Acta (BBA) Bd. 1789, Nr. 1, S. 58–68, PMID 1872256, doi:10.1016/j.bbagrm.2008.07.009.
- Morgan, HD. et al. (2005): Epigenetic reprogramming in mammals. In: Human molecular genetics. (Hum Mol Genet.) Bd. 14, Nr. 1, R47–58, PMID 15809273; PDF (freier Volltextzugriff, engl.)
- Peter Spork et al. (2016): 'Geerbte Angst'; 'Spuren im Stammbaum'; 'Wer trauert, kann das Leid loslassen'; bild der wissenschaft 2/2016, S. 16–25.
Nachschlagewerke und Sachbücher
- Oscar Hertwig: Biological problem of today: preformation or epigenesis? The basis of a theory of organic development. Heinemann, London 1896.
- Joachim Bauer: Das Gedächtnis des Körpers: wie Beziehungen und Lebensstile unsere Gene steuern. Eichborn, Frankfurt am Main 2002; Erweiterte Taschenbuchausgabe: Piper, München 2004 (10. Aufl. 2007), ISBN 978-3-492-24179-3.
- Bernhard Kegel: Epigenetik. Wie Erfahrungen vererbt werden. Dumont, Köln 2009, ISBN 978-3-8321-9528-1.
- Peter Spork: Der zweite Code. Epigenetik – oder wie wir unser Erbgut steuern können. Rowohlt, Reinbek 2009, ISBN 978-3-498-06407-5.
- Wolfgang Wieser: Gehirn und Genom: ein neues Drehbuch für die Evolution. Beck, München 2007, ISBN 3-406-55634-5.
Anderes
- Bruch des bösen Zaubers. In: Der Spiegel. Nr. 32, 2008 (online).
Weblinks
Portale
- The Epigenome Network of Excellence (enthält Verweise auf aktuelle Veröffentlichungen) (engl.)
- Epigenetik: Portal epigenetischer Forschung
- Öffentliches europäisches Epigenom-Netzwerk (mehrsprachig)
- Website des Newsletter Epigenetik
Einzelbeiträge
- Epigenetik: wie Umwelt und Verhalten Gene steuern. Audio auf: funkkolleg-biologie.de, 18. November 2017
- Spuren der Vorfahren auf unserem Erbgut (NZZ 2012)
- „Epigenetik“ bei Planet Wissen abgerufen am 26. Mai 2015
- Warum ist das allen brillanten Genetikern in hundert Jahre nicht aufgefallen? veröffentlicht in Spektrum 26. März 2014
- Stephanie Lahrtz: Gen-Verpackung beeinflusst Verhalten. Umprogrammierte Ameisen. Neue Zürcher Zeitung, 2. Januar 2016, abgerufen am 2. Januar 2016.
Einzelnachweise
- ↑ Rudolf Hagemann: Epigenetik und Lamarckismus haben nichts gemeinsam! In: Laborjournal 4/2009; S. 12
- ↑ Benjamin Lewin: Gene. Lehrbuch der molekularen Genetik, 2. Auflage, VCH, Weinheim 1991, S. 885
- ↑ „The term epigenetics defines all meiotically and mitotically heritable changes in gene expression that are not coded in the DNA sequence itself.“ In: Gerda Egger et al.: Epigenetics in human disease and prospects for epigenetic therapy. Nature 429, S. 457–463 (2004)
- ↑ „... the structural adaptation of chromosomal regions so as to register, signal or perpetuate altered activity states.“ In: Adrian Peter Bird: Perceptions of epigenetics. In: Nature. Band 447, Nummer 7143, Mai 2007, S. 396–398, doi:10.1038/nature05913, PMID 17522671.
- ↑ „However, a tentative definition may be that epigenetics addresses the study of cell lineage formation by non-mutational mechanisms.“ In: Josep Casadesús and David A. Low: Programmed heterogeneity: epigenetic mechanisms in bacteria. In: The Journal of biological chemistry. Band 288, Nummer 20, Mai 2013, S. 13929–13935, doi:10.1074/jbc.R113.472274, PMID 23592777, PMC 3656251 (freier Volltext) (Review).
- ↑ Abbildung von Clapier et al., Proteindatenbank 2PYO; Clapier, CR. et al. (2007): Structure of the Drosophila nucleosome core particle highlights evolutionary constraints on the H2A-H2B histone dimer. In: Proteins 71 (1); 1–7; PMID 17957772; PMC 2443955 (freier Volltext)
- ↑ Tryndiak, VP. et al. (2006): Loss of DNA methylation and histone H4 lysine 20 trimethylation in human breast cancer cells is associated with aberrant expression of DNA methyltransferase 1, Suv4-20H2 histone methyltransferase and methyl-binding proteins. In: Cancer Biol Ther. 5(1), 65–70; PMID 16322686; PDF (freier Volltextzugriff, engl.)
- ↑ "... The Human Epigenome Project, for example, was established in 1999, when researchers in Europe teamed up to identify, catalogue and interpret genomewide DNA methylation patterns in human genes. ..." In: L. Bonetta: Epigenomics : Detailed analysis. In: Nature. Band 454, 2008, S. 796, doi:10.1038/454795a.
- ↑ "... Over time, the field of epigenetics gave rise to that of epigenomics, which is the study of epigenetic modifications across an individual's entire genome. Epigenomics has only become possible in recent years because of the advent of various sequencing tools and technologies, such as DNA microarrays, cheap whole-genome resequencing, and databases for studying entire genomes (Bonetta, 2008) ..." In: L. Bonetta: "Epigenomics: The new tool in studying complex diseases." Nature Education. Band 1, 2008, S. 178, Weblink.
- ↑ K. A. Janssen, S. Sidoli, B. A. Garcia: Recent Achievements in Characterizing the Histone Code and Approaches to Integrating Epigenomics and Systems Biology. In: Methods in enzymology. Band 586, 2017, S. 359–378, doi:10.1016/bs.mie.2016.10.021, PMID 28137571, PMC 5512434 (freier Volltext) (Review).
- ↑ Mario F. Fraga, Esteban Ballestar, Maria F. Paz, Santiago Ropero, Fernando Setien, Maria L. Ballestar, Damia Heine-Suñer, Juan C. Cigudosa, Miguel Urioste, Javier Benitez, Manuel Boix-Chornet, Abel Sanchez-Aguilera, Charlotte Ling, Emma Carlsson, Pernille Poulsen, Allan Vaag, Zarko Stephan, Tim D. Spector, Yue-Zhong Wu, Christoph Plass, and Manel Esteller. Epigenetic differences arise during the lifetime of monozygotic twins. Proceedings of the National Academy of Sciences. 2005. July 26, 2005. Vol. 102. No. 30
- ↑ Frank Lyko, Sylvain Foret u. a.: The Honey Bee Epigenomes: Differential Methylation of Brain DNA in Queens and Workers. In: PLoS Biology. 8, 2010, S. e1000506, doi:10.1371/journal.pbio.1000506.
- ↑ Carlson NR: Physiology of Behavior, 11th, S. 605, New York: Allyn & Bacon 2010, ISBN 978-0-205-23939-9
- ↑ Belanoff JK, Gross K, Yager A, Schatzberg AF: Corticosteroids and cognition. In: Journal of Psychiatric Research. 35, Nr. 3, 2001, S. 127–45. doi:10.1016/S0022-3956(01)00018-8. PMID 11461709.
- ↑ Sapolsky RM: Glucocorticoids, stress and exacerbation of excitotoxic neuron death. In: Seminars in Neuroscience. 6, Nr. 5, October 1994, S. 323–331. doi:10.1006/smns.1994.1041.
- ↑ Patrick O McGowan, Aya Sasaki u. a.: Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse. In: Nature Neuroscience. 12, 2009, S. 342, doi:10.1038/nn.2270.
- ↑ Gewalt an Schwangeren verändert Genetik der Kinder. In: gesundheitsindustrie-bw.de. BIOPRO Baden-Württemberg GmbH, 25. Juli 2011, abgerufen am 16. Februar 2017.
- ↑ E. Susser, R. Neugebauer, H. W. Hoek, A. S. Brown, S. Lin, D. Labovitz, J. M. Gorman: Schizophrenia after prenatal famine. Further evidence. In: Archives of general psychiatry. Band 53, Nummer 1, Januar 1996, S. 25–31, PMID 8540774.
- ↑ R. C. Painter, S. R. de Rooij, P. M. Bossuyt, T. A. Simmers, C. Osmond, D. J. Barker, O. P. Bleker, T. J. Roseboom: Early onset of coronary artery disease after prenatal exposure to the Dutch famine. In: The American Journal of Clinical Nutrition. Band 84, Nummer 2, August 2006, S. 322–327, doi:10.1093/ajcn/84.1.322, PMID 16895878.
- ↑ B. T. Heijmans, E. W. Tobi, A. D. Stein, H. Putter, G. J. Blauw, E. S. Susser, P. E. Slagboom, L. H. Lumey: Persistent epigenetic differences associated with prenatal exposure to famine in humans. In: Proceedings of the National Academy of Sciences. Band 105, Nummer 44, November 2008, S. 17046–17049, doi:10.1073/pnas.0806560105, PMID 18955703, PMC 2579375 (freier Volltext).
- ↑ Maze, L. Nestler, E.J.: The Epigenetic Landscape of Addiction. In: Annals of the New York Academy of Sciences 1216, S. 99–113, 2011.
- ↑ Tsankova, N. et al. Epigenetic Regulation in Psychiatric Disorders. in. Nature Reviews Neuroscience 8, S. 355–367. 2007
- ↑ spiegel.de: Epigenetik: Mütter können Erfahrungen vererben, 4. Februar 2009.
- ↑ Ernährung aktuell, (Von der Österreichischen Gesellschaft für Ernährung wird viermal im Jahr die Zeitschrift „Ernährung aktuell“ herausgegeben.) 1/2007 S. 1–6
- ↑ Waterland, RA. und Jirtle, RL. (2003): Transposable elements: targets for early nutritional effects on epigenetic gene regulation. In: Mol Cell Biol. 23(15); 5293-5300; PMID 12861015; PMC 165709 (freier Volltext)
- ↑ M. E. Pembrey, L. O. Bygren, G. Kaati, S. Edvinsson, K. Northstone, M. Sjöström, J. Golding: Sex-specific, male-line transgenerational responses in humans. In: European journal of human genetics : EJHG. Band 14, Nummer 2, Februar 2006, S. 159–166, doi:10.1038/sj.ejhg.5201538, PMID 16391557; PDF (freier Volltextzugriff, engl.)
- ↑ scinexx.de: Umwelt oder Gene? Die Antwort der Zwillinge, 26. Februar 2013.
- ↑ William R. Rice, Urban Friberg, and Sergey Gavrilets: Homosexuality as a Consequence of Epigenetically Canalized Sexual Development. The Quarterly Review of Biology, Vol. 87, Nr. 4, Dezember 2012, PMID 23397798; ... Die Autoren verwendeten "published data ... to develop a new model for homosexuality."
- ↑ 29,0 29,1 Heinz J. Voß: Epigenetik und Homosexualität (PDF; 564 kB).
- ↑ Jörg Tost: Epigenetics. Norfolk, England: Caister Academic Press 2008, ISBN 1-904455-23-9
- ↑ Casadesús J, Low D: Epigenetic gene regulation in the bacterial world. In: Microbiol. Mol. Biol. Rev.. 70, Nr. 3, September 2006, S. 830–56. doi:10.1128/MMBR.00016-06. PMID 16959970. Volltext bei PMC: 1594586.
- ↑ Manso AS, Chai MH, Atack JM, Furi L, De Ste Croix M, Haigh R, Trappetti C, Ogunniyi AD, Shewell LK, Boitano M, Clark TA, Korlach J, Blades M, Mirkes E, Gorban AN, Paton JC, Jennings MP, Oggioni MR: A random six-phase switch regulates pneumococcal virulence via global epigenetic changes. In: Nature Communications. 5, September 2014, S. 5055. doi:10.1038/ncomms6055. PMID 25268848. Volltext bei PMC: 4190663.
| Dieser Artikel basiert ursprünglich auf dem Artikel Epigenetik aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |