| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Cobalamine
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Coenzym B12 (= AdoCbl): R = 5′-Desoxyadenosyl Cyanocobalamin (= Vitamin B12): R = –C≡N Aquocobalamin (= Vitamin B12a): R = –OH2 Hydroxycobalamin (= Vitamin B12b): R = –OH Methylcobalamin (= MeCbl oder MeB12): R = –CH3 | |||||||||
| Allgemeines | |||||||||
| Trivialname | 5′-Desoxyadenosylcobalamin | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C72H100CoN18O17P | ||||||||
| CAS-Nummer |
| ||||||||
| PubChem | 16072210 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB00115 | ||||||||
| Kurzbeschreibung | roter, kristalliner Feststoff (Cyanocobalamin) | ||||||||
| Vorkommen | tierische Produkte | ||||||||
| Physiologie | |||||||||
| Funktion | Zellteilung, Blutbildung, Funktion des Nervensystems | ||||||||
| Täglicher Bedarf | 3 µg[1] | ||||||||
| Folgen bei Mangel | Perniziöse Anämie, neurologische Erkrankungen (z. B. funikuläre Myelose), Glossitis, Diarrhöen | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | |||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt |
zersetzt sich ab 392 °C (Cyanocobalamin) | ||||||||
| Löslichkeit | wenig löslich in Wasser: 12 g·l−1, unlöslich in Ether, Aceton und Chloroform (Cyanocobalamin) | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Cobalamine sind chemische Verbindungen, die in allen Lebewesen vorkommen und auch als Vitamin-B12-Gruppe bezeichnet werden. Der wichtigste Vertreter aus der Cobalamin-Gruppe ist das Coenzym B12, das als Kofaktor (Coenzym) Teil mehrerer Enzyme ist. Beim Menschen sind zwei Cobalamin-abhängige Enzyme bekannt, die am Stoffwechsel der Aminosäuren teilnehmen. Cobalamine enthalten das Spurenelement Cobalt als Zentralatom.[4][5]
Die biologisch inaktive Form Cyanocobalamin ist das Vitamin B12 im engeren Sinne. Cyanocobalamin wird in der Medizin als Vitamin verwendet und vom menschlichen Organismus in das biologisch aktive Adenosylcobalamin (Coenzym B12) umgewandelt. Adenosylcobalamin (AdoCbl) wird auch als Extrinsic-Faktor bezeichnet (englisch extrinsic factor).
Ebenfalls zur Vitamin-B12-Gruppe gehören die Speicherformen
- Aquocobalamin bzw. Aquacobalamin (Vitamin B12a, die konjugierte Säure des Hydroxocobalamins),
- Hydroxocobalamin bzw. Hydroxycobalamin (Vitamin B12b) und
- Nitritocobalamin (Vitamin B12c).
Methylcobalamin (Methyl-B12, MeCbl) ist eine weitere biologisch wirksame Coenzym-Form neben Adenosylcobalamin (Coenzym B12).
Nomenklatur
Vor allem in der Ernährungsliteratur wird die Bezeichnung Vitamin B12 auch für das Coenzym B12, andere Cobalamine oder für die ganze Cobalamin-Gruppe gebraucht. Die chemische Nomenklatur reserviert diesen Begriff aber allein für das biologisch inaktive Cyanocobalamin.[6][7][8] Im Folgenden ist daher mit Vitamin B12 im Sinne einer chemischen Verbindung stets Cyanocobalamin gemeint und nicht Adenosylcobalamin (Coenzym B12).
Aus historischen Gründen wird die Bezeichnung Adenosylcobalamin oft auch für Cyanocobalamin benutzt (das synthetische, biologisch inaktive Vitamin B12), ebenfalls im Widerspruch zur chemischen Nomenklatur.
Nicht zu verwechseln mit den eigentlichen Cobalaminen sind die Transcobalamine, bei denen es sich lediglich um Transportproteine für Vitamin B12 handelt.
Geschichte
Nachdem schon Anfang der 1920er Jahre der US-amerikanische Pathologe George H. Whipple entdeckt hatte, dass Hunde, die an perniziöser Anämie (bösartige Blutarmut) litten, durch Fütterung mit roher Leber von dieser sonst tödlich verlaufenden Krankheit geheilt werden konnten, führte die Suche nach der essenziellen Komponente dieser Heilmethode schließlich 1926 zur Beschreibung eines auch beim Menschen wirksamen Antiperniziosa-Faktors durch die beiden US-amerikanischen Ärzte George R. Minot und William P. Murphy,[9] die dafür zusammen mit Whipple 1934 den Nobelpreis für Medizin erhielten.
Die Isolierung des eigentlichen Wirkstoffs dagegen, des Vitamins B12 (Cyanocobalamin), gelang in kristalliner Form erst 1948, und das unabhängig voneinander zum einen einem Team amerikanischer Biochemiker um Karl A. Folkers, zum anderen einem britischen Forscherteam um den Chemiker E. Lester Smith.
1955 schließlich konnte die britische Biochemikerin Dorothy C. Hodgkin mit Hilfe der Röntgenbeugung an Vitamin-B12-Einkristallen auch deren Molekülstruktur aufklären, wofür sie u. a. 1964 mit dem Nobelpreis für Chemie geehrt wurde.[10]
Die darauf aufbauende Totalsynthese des Vitamins B12 gelang 1972 Albert Eschenmoser und Robert B. Woodward[11] und noch heute gilt Vitamin B12 damit als eines der größten jemals in einem Labor totalsynthetisierten Moleküle.
Beschreibung
Cobalamine sind organometallische Verbindungen mit einem zentralen ein-, zwei- oder dreifach positiv geladenen Cobalt-Ion und als solche die bisher einzigen bekannten cobalthaltigen Naturstoffe.
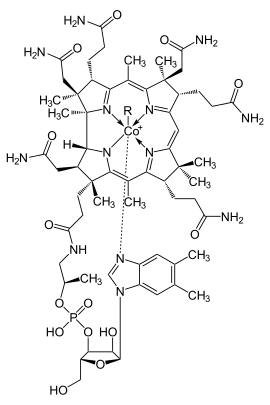
Alle Cobalamine besitzen dabei dieselbe Grundstruktur eines Cobaltkomplexes, in dem das Cobaltkation von fünf Stickstoffatomen und einem sechsten, i.d.R. austauschbaren Liganden umgeben ist, siehe Abbildung. Vier der Stickstoffatome gehören zu einem ebenen Corrin-Ringsystem, das das Cobaltkation so fest umschließt, dass es nur durch Zerstörung des Ringsystems wieder herausgelöst werden kann, während das fünfte Stickstoffatom zu einem nucleotidartig an den Corrinring gebundenen 5.6-Dimethyl-benzimidazol-Ring gehört.
Namensgebend für das jeweilige Cobalamin indes ist der sechste, austauschbare Ligand, der in den chemischen Strukturformeln meist mit R (für Rest) abgekürzt wird: Ist R eine Hydroxygruppe, handelt es sich bei dem Cobalamin um Hydroxycobalamin, ist R eine Cyanogruppe, um Cyanocobalamin, und bei einem 5'-Desoxyadenosylliganden als Rest um 5'-Desoxyadenosylcobalamin, kurz Coenzym B12.
Meist ist der sechste Ligand R nur schwach an das Cobaltkation gebunden, so dass er leicht durch andere Liganden austauschbar ist und der menschliche Organismus zum Beispiel das therapeutisch eingesetzte Hydroxycobalamin oder Cyanocobalamin (Vitamin B12) durch Austausch der Hydroxy- gegen eine Cyanogruppe und dieser wiederum gegen eine 5'-Desoxyadenosylgruppe in das eigentlich biochemisch aktive Coenzym B12 umwandeln kann.
Cyanocobalamin (Vitamin B12) selbst ist eine geruchlose, tief dunkelrote, kristalline hygroskopische Substanz, die sich nur mäßig in Wasser und niederen Alkoholen, dagegen gar nicht in (apolaren) organischen Lösungsmitteln wie Aceton, Chloroform oder Ether löst.
Im leicht sauren pH-Bereich von 4-6 ist Vitamin B12 recht temperaturstabil. In basischen Lösungen und in Gegenwart von Reduktionsmitteln wie Ascorbinsäure und SO2 können in Lebensmitteln größere Verluste auftreten.[12]
In der Zelle kommen Cobalamine im Cytosol vor allem als Methylcobalamin, in den Mitochondrien dagegen überwiegend als 5'-Desoxyadenosylcobalamin (Coenzym B12) vor. Die Abbildung oben zeigt die allgemeine Strukturformel der Cobalamine mit R als austauschbarem Liganden.
Funktion im Organismus
Vereinfachend zusammengefasst ist Vitamin B12 wichtig für die Zellteilung und Blutbildung sowie die Funktion des Nervensystems.
Coenzym B12 nimmt im humanen Organismus als Coenzym an nur zwei enzymatischen Reaktionen teil:
- N5-Methyl-Tetrahydrofolat-Homocystein-S-Methyltransferase (Methionin-Synthase)[13] und
- Methylmalonyl-CoA-Mutase[14]
Die Reaktion der Methionin-Synthase[15] dient u. a. der Regeneration des Methylgruppenüberträgers S-Adenosylmethionin (SAM) bzw. der Bildung von Methionin. Dabei wird Homocystein zum Methionin remethyliert. Gelingt dies nicht, bildet sich vermehrt Homocystein, ein Zwischenprodukt beim Abbau der Aminosäure Methionin (erhöhte Homocysteinspiegel werden mit der Bildung von Arteriosklerose in Zusammenhang gebracht). Als Methylgruppendonator fungiert dabei N5-Methyl-Tetrahydrofolat (N5-Methyl-THF). Fehlt Coenzym B12, so reichert sich N5-Methyl-THF an und es kommt zu einem sekundären Mangel an THF, welches für die Synthese der Purinbasen Adenin und Guanin und der Pyrimidinbase Thymin erforderlich ist. Durch einen Mangel an diesen Nukleobasen ist die Synthese insbesondere von DNA aber auch RNA gestört. Dies äußert sich vorrangig in Organen mit hoher Zellteilungsaktivität wie dem Knochenmark. Es kommt zu einer mehr oder minder ausgeprägten Panzytopenie im Blut, wobei der Mangel an Erythrozyten – die Anämie – am offensichtlichsten ist. Die verbleibenden Erythrozyten werden mit Hämoglobin so stark angereichert, dass sie einen höheren Hämoglobingehalt als normale Erythrozyten haben. Auch sind diese Zellen etwas größer. Daher spricht man von einer hyperchromen, makrozytären Anämie. Durch die Gabe von Folsäure kann dieser Block umgangen werden, jedoch löst dieser Ansatz nicht den zugrundeliegenden Vitamin-B12-Mangel, so dass die Behandlung der perniziösen (wörtl. gefährlich) oder megaloblastären Anämie bei Vitamin-B12-Mangel mit Folsäure einen Kunstfehler darstellt.
Der Grund hierfür ist die zusätzliche Funktion des Vitamin B12 in der Methylmalonyl-CoA-Mutase. Diese dient der Einschleusung des terminalen Propionyl-CoAs ungeradzahliger Fettsäuren, sowie Teilen des Kohlenstoffgerüstes der Aminosäuren Valin, Isoleucin, Threonin und Methionin in den mitochondrialen Citratzyklus. Das im Rahmen des Abbaus dieser Verbindungen aus Propionyl-CoA (in einem Biotin-abhängigen Schritt) gebildete Methylmalonyl-CoA wird durch die Vitamin-B12-abhängige Methylmalonyl-CoA-Mutase zu Succinyl-CoA, einem Zwischenprodukt des Citratcyclus, umgesetzt.
Ist dieser Schritt gehemmt, kommt es zu einem Anstieg von Methylmalonsäure im Plasma und vor allem im Urin. Dieser Stoffwechselweg spielt offenbar eine besondere Rolle im ZNS, da sich ein Vitamin-B12-Mangel bisweilen sogar vor der typischen Anämie mit Symptomen wie z. B. der funikulären Myelose, einer Störung der Pyramidenbahn und der Hinterstränge, aber auch scheinbaren Altersdemenzen und anderem bemerkbar macht. Daher sollte insbesondere bei älteren Patienten mit neurologischer Symptomatik ein Vitamin-B12-Mangel als mögliche (Mit-)Ursache ausgeschlossen und ggf. behandelt werden. Erste neurologische Symptome äußern sich als so genannte Polyneuropathie in Form von Kribbelparästhesien oder anderen Missempfindungen (z. B. leichtes Brennen) in verschiedenen Körperregionen, die anfangs nur vorübergehend sind.
Vorkommen
| Lebensmittel | Gehalt in µg/100 g (siehe Hinweis[20][21]) |
|---|---|
| Kalbsleber | 60 |
| Spirulina maxima (Cyanobakterium) | 57 |
| Schweineleber | 40 |
| Schweineniere | 20 |
| Hühnerleber | 20 |
| Nori (Porphyra tenera) | 15 |
| Makrele | 9 |
| Hering | 8,5 |
| Rindfleisch (Muskel) | 5,0 |
| Thunfisch | 4,3 |
| Käse | 3,0 |
| Hühnereigelb | 2,0 |
| Brottrunk | 1,1 |
| Aal | 1 |
| Blutwurst | 1 |
| Schweinefleisch (Muskel) | 0,8 |
| Kuhmilch | 0,4 |
| Sojasauce | 0,3 |
| Tempeh | 0,3 |
| Ingwer | 0,16 |
| Hühnereiweiß | 0,1 |
| Gemüse | 0,01 |
| Kabeljau | 0,5–0,8 |
| Sauerkraut | 0 |
Cobalaminquellen
Der menschliche und tierische Organismus sowie Pflanzen sind nicht in der Lage, Vitamin B12 selbst herzustellen. Vitamin B12 wird in der Natur von Mikroorganismen – insbesondere Bakterien – produziert,[22] die als Symbionten sowohl im Verdauungstrakt von Tieren als auch auf der Oberfläche pflanzlicher Wirte (z. B. Leguminosen) vorkommen.[23]
Im menschlichen und tierischen Organismus wird Vitamin B12 vor allem in Leber und Niere akkumuliert, in Pflanzen kann es nur in Spuren vorkommen.[23]
Alles- und Fleischfresser decken ihren B12-Bedarf durch den Konsum von Fleisch, insbesondere Innereien. Für Vegetarier stellen Milchprodukte und Eier trotz ihres vergleichsweise geringen Gehalts bedeutende natürliche Quellen dar. Bei Wiederkäuern wird das Vitamin im Vormagen, bei anderen Pflanzenfressern im Dickdarm gebildet. Da das im Darm produzierte B12 bei Geflügel und Schweinen jedoch nur unzureichend resorbiert wird, sind diese Arten auf eine exogene Versorgung über ihr Futter angewiesen. Ein Mangel bei Wiederkäuern beruht in der Regel auf unzureichender Cobaltzufuhr.[24] In der Tierproduktion wird dem Futter in Spuren Cobalt hinzugefügt, falls die Tiere von cobaltarmen Weideflächen ernährt werden müssen. Hierüber soll Wachstums- und Laktationsstörungen, Blutarmut und Appetitlosigkeit entgegengewirkt werden.[25]
Man nimmt an, dass Pflanzenfresser den Hauptteil ihres Bedarfes über eine Symbiose mit Mikroorganismen ihrer Darmflora decken. Auch beim Menschen kommen Mikroorganismen im Darm vor, die Vitamin B12 produzieren. Allerdings erfolgt die Synthese vor allem im Dickdarm, während die Absorption nur im terminalen Ileum, also kurz vor dem Dickdarm erfolgen kann. Daher wird das im menschlichen Dickdarm gebildete Vitamin B12 ungenutzt ausgeschieden.[26]
Cobalamingehalt einiger Lebensmittel
Hinweis zur Tabelle: Die Angaben entsprechen nicht dem Gehalt des vom menschlichen Organismus verwendbaren Vitamins der Lebensmittel. Vor allem der Bestandteil in unvergorenen pflanzlichen Lebensmitteln wie Spirulina ist eher auf Pseudovitamin B12 zurückzuführen, das bei Säugetieren nahezu keine biologische Wirksamkeit besitzt.[21]
Durch Milchsäuregärung haltbar gemachte Gemüse, manche Algensorten sowie Leguminosen – wie etwa Erbsen, Bohnen und Lupinen – und Zingiberales wie Ingwer besitzen einen, wenn auch geringen, Gehalt an B12-Coenzymen.[16]
Nach etablierter Fachmeinung enthält keine pflanzliche Nahrung für den menschlichen Bedarf ausreichende Mengen der verwertbaren Form des Vitamins, dies gilt insbesondere auch für fermentierte Sojaprodukte.[27] Watanabe et al. untersuchten verschiedene pflanzliche Quellen und fanden 2014, dass darunter die Koreanische Rotalge die beste Vitamin-B12-Quelle für Vegetarier sei. Nach Berechnung der Autoren könnte der tägliche Konsum von 4 g der getrockneten Meeresalge, die in dieser Form auch unter der kulinarischen Bezeichnung Nori bekannt ist, einen Vitaminbedarf in Höhe von 2,4 µg decken. Diese Aussage beruht auf Daten aus einer In-vitro-Verdauungssimulation, die Bioaktivität wurde im Tierversuch geprüft.[28]
Vitamin B12 ist in fast allen Nahrungsmitteln tierischer Herkunft (auch Eiern und Milchprodukten) enthalten. Im Vergleich zu Kuhmilch (0,4 µg/100 g) enthält Muttermilch nur durchschnittlich 0,05 µg/100 g.[29]
Bedarf
Der tägliche Mindestbedarf, der im Vergleich zu den meisten anderen Vitaminen viel geringer ist, beträgt nur ca. 3 µg (Mikrogramm) für einen Erwachsenen. Für die ersten vier Lebensmonate wird der Vitamin-B12-Bedarf auf 0,4 µg pro Tag geschätzt, Säuglinge zwischen dem 4. und 12. Lebensmonat benötigen 0,8 µg pro Tag. Bei Kindern steigt der Bedarf mit dem Alter von 1,0 µg (1 Jahr) bis auf 3,0 µg (13 bis unter 15 Jahre). Bei Schwangeren und Stillenden wird ein erhöhter Bedarf von 3,5–4 µg angenommen.[1]
Die biologische Halbwertszeit des Vitamins B12 beträgt 450–750 Tage. Das Vitamin wird ständig mit Gallensäuren in den Dünndarm abgegeben und an dessen Ende – dem Ileum – mithilfe des intrinsischen Faktors wieder aufgenommen. Der Bedarf ergibt sich also aus den Mengen, die im Ileum nicht wieder rückresorbiert werden konnten, abzüglich der Mengen, die möglicherweise schon dort durch Mikroorganismen produziert werden. Falls es zur Störung bei der Bildung des intrinsischen Faktors kommt, kann das Vitamin gar nicht mehr aufgenommen oder rückresorbiert werden, wodurch sich die Speicher im Organismus schnell leeren. Die meisten Fälle von Mangel an Vitamin B12 werden durch Störungen bei der Bildung des intrinsischen Faktors verursacht.
Gesunde Erwachsene speichern in ihrer Leber 2000–5000 µg Vitamin B12. Das gefüllte Depot reicht aus, um eine Unterversorgung über mehrere Jahre hinweg auszugleichen. Anders ist die Situation bei Säuglingen; diese verfügen über wesentlich geringere Reserven.[30] Die Leber eines gut ernährten Neugeborenen enthält nur 25–30 µg des Vitamins.[31] Gestillte Kinder von Frauen, die sich vegan ernähren und deren Muttermilch arm an Vitamin B12 ist, entwickeln ohne Zufütterung tierischer Lebensmittel meist im zweiten Lebenshalbjahr Symptome eines Mangels.[30] Die bei vegetarischer Ernährungsweise typischerweise hohe Folsäurezufuhr vermag die hämatologischen Symptome einer Vitamin-B12-Unterversorgung zu überdecken, so dass der Mangel bis zum Auftreten neurologischer Symptome unentdeckt bleibt.[27]
Vitamin-B12-Mangel
Mangelerscheinungen
Bei einem Mangel an Vitamin B12 kann es zur perniziösen Anämie (Perniziosa), einer Erkrankung des Blutbildes, und zur funikulären Myelose – einer Schädigung des Zentralnervensystems – kommen. In den letzten Jahren mehrten sich zudem die Hinweise auf einen möglichen Zusammenhang zwischen einem Vitamin-B12-Mangel und anderen Krankheitsbildern wie z. B. Demenz und Neuropathien. Grundsätzlich sind niedrige Vitamin-B12-Konzentrationen im Blutserum bei älteren Menschen häufiger zu beobachten.
Ein Mangel kann durch unzureichende Zufuhr mit der Nahrung oder durch unzureichende Resorption verursacht werden. Bei mangelhafter Aufnahmefähigkeit im Magen-Darm-Trakt fehlt dem Organismus im Magensaft der intrinsische Faktor, ein Glykoprotein, das von den Belegzellen des Magens produziert wird und für die Vitamin-B12-Aufnahme unabdingbar ist. Der intrinsische Faktor bindet Cobalamin in einem vor Verdauungsenzymen geschützten Komplex und ermöglicht so den Transport in die Darmzellen, von wo aus Vitamin B12 über Bindung an weitere Proteine (Transcobalamine) in die äußeren Gewebe gelangt. Auch eine Störung bei der Aufnahme im terminalen Ileum kann zu einem Mangel führen.
Die ersten Anzeichen von Vitamin-B12-Unterversorgung bei erwachsenen Personen können Kribbeln und Kältegefühl in Händen und Füßen, Erschöpfung und Schwächegefühl, Konzentrationsstörungen und sogar Psychosen sein.
Typische Folgen eines Vitamin-B12-Mangels sind:
- Methylmalonat-Acidurie (fehlende Methylmalonyl-CoA-Mutase-Aktivität)
- Homocystinurie (fehlende Methionin-Synthase-Aktivität, ggf. sekundär Methionin-Mangel)
- Megaloblastäre Anämie (Störung des Folsäurestoffwechsels durch Block der N5-Methyl-THF-Spaltung zu THF)
- Hypersegmentierte Leukozyten (Zeichen der Überalterung aufgrund der Syntheseprobleme)
- sensorische Neuropathie (wohl Folge der fehlenden Methylmalonyl-CoA-Mutase-Aktivität und der Anämie)
Vitamin B12, gebunden an das aus den Belegzellen des Magens stammende Glykoprotein intrinsischer Faktor, wird physiologisch im terminalen Ileum absorbiert. Nach einer Magenresektion oder bei einer Autoimmungastritis (A-Gastritis), bei der sich die Immunreaktion gegen die den intrinsischen Faktor bildenden Belegzellen (=Parietalzellen) richtet, ist daher die Aufnahme des Vitamin B12 – zumindest bei normalem Angebot – kaum möglich, so dass sich in der Folge ein Vitamin-B12-Mangel ausbilden kann. Auch bei einer schweren Entzündung des Ileums, insbesondere dem Morbus Crohn (= Ileitis terminalis), aber auch anderen intestinalen Erkrankungen mit Malabsorptionssyndrom, oder nach Resektionen des terminalen Ileum bzw. des Magens, kommt es typischerweise zu einem Vitamin-B12-Mangel.
In diesen Fällen ist eine regelmäßige Substitution von Vitamin B12 erforderlich, wobei diese jedoch unter Umgehung des Magen-Darm-Traktes in Form von intramuskulärer, subcutaner oder selten auch intravenöser Injektion erfolgen sollte, da entweder der fehlende intrinsic factor oder das fehlende bzw. stark gestörte Ileum die Aufnahme des oral zugeführten Vitamin B12 weitgehend verhindern würde. Nur bei Gabe hoher Dosen wird Vitamin B12 auch unspezifisch aufgenommen. Dabei ist jedoch die Resorptionsquote nicht vorhersehbar und daher ist eine orale Vitamin-B12-Substitution in diesen Fällen im Allgemeinen ungenügend.
Das erste wirksame Präparat zur Behandlung der perniziösen Anämie, das in den 1930er Jahren entwickelte Campolon, beruhte auf gereinigten Extrakten aus Lebern von Schlachttieren und enthielt Vitamin B12 als Hauptbestandteil. Es löste die zuvor praktizierte Leberdiät ab, bei der die Patienten täglich rohe Leber oder daraus hergestellte Speisen zu sich nehmen mussten.
Seit der Jahrtausendwende wird zur Bestimmung des Cobalamin-Spiegels im Blut normalerweise ein CBLA-Assay durchgeführt (competitive-binding luminescence assay), der frühere mikrobiologische und Radioisotopen-Dilutions-Assays abgelöst hat. Dieser wird von drei Herstellern angeboten. Klinische Serien zeigen, dass alle drei Assays eine hohe Rate falsch-negativer Ergebnisse (zwischen 22 und 35 %) produzieren, d.h. in einem von drei bis vier Fällen wird statt eines Cobalamin-Mangels fälschlicherweise ein Normalspiegel ermittelt. Allerdings liegen bisher nur kleine Serien vor.[32]
Test auf Vitamin-B12-Mangel
Ein latenter Vitamin-B12-Mangel verändert u. a. vier im Blut messbare Biomarker mit Fortschreiten des Mangelzustands. Der bei dauerhafter Vitamin-B12-Unterversorgung sensitivste und als erster auffällig werdende Laborwert ist hierbei der Wert für Holotranscobalamin (Holo-TC) im Serum. Ist nur der Holo-TC-Wert verringert, so treten in diesem Stadium noch keine klinischen oder hämatologischen Symptome auf. Die Feststellung eines Vitamin-B12-Mangels in diesem Stadium erlaubt eine Substitutionstherapie, bevor irreversible neurologische Schädigungen auftreten.[33]
Bei einem fortschreitenden Mangel können auch erhöhte Homocysteinwerte sowie erhöhte Werte für die Methylmalonsäure (MMA) auftreten. Diese Werte müssen daher in der Regel erst bei Auffälligkeit des Holo-TC-Wertes oder bei anderweitigem Verdacht auf Vitamin-B12-Mangel (bspw. bei erhöhtem Kreatinin) abgeprüft werden. Der Gesamt-Vitamin-B12-Spiegel im Serum ist oft der zuletzt abfallende und dazu relativ unspezifische und unsensitive Bio-Marker zur Feststellung einer latenten Vitamin-B12-Mangelversorgung, demzufolge ist die Aussagekraft dieses Parameters zur frühzeitigen Feststellung eines Vitamin-B12-Mangels limitiert.[33]
Überdosierung
Therapeutische – meist intravenöse – Überdosen werden mit lokalen allergischen Beschwerden[34] sowie einer Form der Akne (Acne medicamentosa) in Verbindung gebracht.[35]
Weitere Verwendung
Verwendung als Gegengift
Hydroxycobalamin ist ein Antidot bei Vergiftungen durch Cyanide bzw. Blausäure. Cyanidvergiftungen kommen hauptsächlich im Rahmen von Kunststoffbränden vor. Weitere Ursachen können die versehentliche oder absichtliche Einnahme, das Einatmen oder ein Hautkontakt bei Industrieunfällen sein.
Die klinische Symptomatik Koma, Bradykardie und Hypotonie von Rauchgasexponierten im Rahmen eines Brandes sollte an eine Cyanidintoxikation denken lassen. Wie Kohlenmonoxid und Nitrose Gase ist auch Blausäure im Rahmen der Brandbekämpfung messbar und erhärtet den Verdacht auf eine Intoxikation. Die Therapie mit 4-Dimethylaminophenol (4-DMAP) ist bei Rauchgasexponierten zu meiden, da dies als Met-Hämoglobinbildner die Oxigenierung negativ beeinflusst.
Unter dem Handelsnamen Cyanokit erhielt die Firma Merck KGaA am 29. November 2007 für Hydroxocobalamin über das zentralisierte Verfahren von der Europäischen Kommission die Marktzulassung zur Behandlung erwiesener oder vermuteter Cyanidvergiftung bei Erwachsenen und Kindern.[36] Hydroxocobalamin ist eine Form von Vitamin B12, das Cyanid-Ionen bindet. Dabei entsteht Cyanocobalamin, das über die Nieren mit dem Urin ausgeschieden wird. So wird die Bindung des Cyanids an die Cytochrom-c-Oxidase verhindert. Die Anfangsdosis für Cyanokit bei Erwachsenen liegt bei 5 g des Wirkstoffes, die als intravenöse Infusion zu verabreichen ist. In Abhängigkeit von der Schwere der Vergiftung und der klinischen Reaktion kann eine zweite Dosis von 5 g bis zu einer Gesamtdosis von 10 g verabreicht werden.
Das Risiko-Nutzen-Verhältnis im Rahmen der Behandlung der Zyanidvergiftung mit Hydroxocobalamin ist gut. Als häufige Nebenwirkung kommt es zu einer harmlosen ca. eine Woche andauernden Rotfärbung der Haut und des Urins, sowie zu einem leichten Blutdruckanstieg.[37]
Topische Anwendung auf der Haut
Cyanocobalamin wird alternativmedizinisch zur Behandlung des Atopischen Ekzems (Neurodermitis) und der Schuppenflechte (Psoriasis) eingesetzt. Die Wirkung wird mit den Ergebnissen kleinerer klinischer Studien begründet, in denen eine Salbe mit 0,07 % Vitamin-B12 (Cyanocobalamin) in einer Avocadoöl-Salbengrundlage untersucht wurde.[38][39][40]
Es wird vermutet, dass die in den Studien beobachtete Wirkung darauf zurückzuführen ist, dass Cyanocobalamin die Fähigkeit besitzt, Stickstoffmonoxid zu binden, welches bei den symptomatischen Hautveränderungen in erhöhter Konzentration auftrete und zellschädigend wirke.
Bevor die Salbe im November 2009 unter dem Markennamen Regividerm als Medizinprodukt auf den Markt gebracht wurde, fand sie durch die Fernsehdokumentation Heilung unerwünscht – Wie Pharmakonzerne ein Medikament verhindern, die am 19. Oktober 2009 von der ARD gesendet wurde, ein großes und im Verlauf auch kritisches Medieninteresse.[41][42][43][44] Peter Schönhöfer, ein klinischer Pharmakologe, der vom WDR im Rahmen der Produktion dieser Dokumentation mit der Begutachtung der Studien beauftragt worden war, zog ihre Aussagekraft kurz nach der Sendung in Zweifel, da aufgrund der niedrigen Patientenzahlen überhaupt keine belastbare Aussage darstellbar sei. Seine schon während der Produktion dem WDR gegenüber ausgesprochenen Warnungen seien ignoriert worden.[45] Der Dermatologe und Studien-Koautor Peter Altmeyer äußerte gegenüber FOCUS, seine kleine Seitenvergleichsstudie ohne Kontrollgruppe mit 13 Psoriasis- und 49 Neurodermitispatienten sei von der ARD hochgejubelt und falsch interpretiert worden. Für einen Beweis der Wirksamkeit wäre ein Feldversuch mit einigen tausend Patienten notwendig.[42]
Seit März 2010 darf das Produkt nicht mehr unter dem Namen Regividerm vertrieben werden, es heißt nun Mavena B12 Salbe.[46]
Siehe auch
Literatur
- Wolfgang Herrmann, Rima Obeid: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel. In: Deutsches Ärzteblatt. Band 105, Nr. 40, 2008. S. 680–685. doi:10.3238/arztebl.2008.0680
- Wolfgang Herrmann, Rima Obeid (Hrsg.): Vitamins in the prevention of human diseases. 2011, ISBN 978-3-11-021448-2.
- Elzen et al.: Subnormal vitamin B12 concentrations and anaemia in older people: a systematic review. In: BMC Geriatrics. Band 10, 2010. doi:10.1186/1471-2318-10-42
- aerztezeitung.de: Vitamin B12 beugt möglicherweise Alzheimer vor
- E. V. Quadros: Advances in the understanding of cobalamin assimilation and metabolism. In: British Journal of Haematology. Band 148, Nummer 2, Januar 2010, S. 195–204, doi:10.1111/j.1365-2141.2009.07937.x. PMID 19832808. PMC 2809139 (freier Volltext). (Review).
- R. Carmel: Cobalamin, the stomach, and aging. In: The American journal of clinical nutrition. Band 66, Nummer 4, Oktober 1997, S. 750–759, PMID 9322548. (Review).
Weblinks
- Die Aufnahme von Vitamin B12 (Übersichtsgrafik)
- Vitamin B 12 - Vitalstoff für Blut und Nerven
Einzelnachweise
- ↑ 1,0 1,1 DGE Referenzwerte für die Nährstoffzufuhr (D-A-CH Referenzwerte der DGE, ÖGE, SGE/SVE) Vitamin B12 (Cobalamine).
- ↑ 2,0 2,1 2,2 Datenblatt Coenzyme B12, ≥97.0% bei Sigma-Aldrich, abgerufen am 27. Dezember 2012 (PDF).
- ↑ Eintrag zu Cobalamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM).
- ↑ Hans Beyer: Lehrbuch der organischen Chemie. Leipzig 1968, S. 617–618
- ↑ UniProt-Suchergebnis
- ↑ W. Kaim, B. Schwederski: Bioanorganische Chemie – Zur Funktion chemischer Elemente in Lebensprozessen. 4. Auflage. Teubner, 2005.
- ↑ G. Langley: Vegane Ernährung. Echo, 2005.
- ↑ K. Folkers: Perspectives from research on vitamins and hormones. In: Journal of Chemical Education. Band 61, 1984, S. 747.
- ↑ G. R. Minot, W. P. Murphy: Treatment of pernicious anaemia by a special diet. In: Journal of the American Medical Association. Band 87, 1926. S. 470-476.
- ↑ Manuskript ihres Festvortrages anlässlich der Verleihung des Nobelpreises (PDF-Datei; 343 kB).
- ↑ Peter Bützer: Dynamik von Vitamin B12, Cobalamin., abgerufen am 5. Juni 2013 (PDF, 481 kB).
- ↑ Der BibISBN-Eintrag Vorlage:BibISBN/9783540732013 ist nicht vorhanden. Bitte prüfe die ISBN und lege ggf. einen neuen Eintrag an.
- ↑ EC 2.1.1.13
- ↑ EC 5.4.99.2 EC 5.4.99.2
- ↑ Methionine Synthase (Schaubild).
- ↑ 16,0 16,1 Mechthild Busch-Stockfisch: Lebensmittel-Lexikon. 4. Auflage. Behr’s Verlag DE, 2005, ISBN 978-3-89947-165-6.
- ↑ H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-73201-3. S. 418.
- ↑ Vitamin B12. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2013.
- ↑ B12 in Lebensmitteln: In welchen Lebensmitteln kommt Vitamin B12 vor? vitamin-b12-mangel.org, abgerufen am 11. Februar 2013.
- ↑ Die Angaben entsprechen nicht dem Gehalt des vom menschlichen Organismus verwendbaren Vitamins der Lebensmittel. Vor allem der Bestandteil in unvergorenen pflanzlichen Lebensmitteln wie Spirulina ist eher auf Pseudovitamin B12 zurückzuführen, das bei Säugetieren nahezu keine biologische Wirksamkeit besitzt
- ↑ 21,0 21,1 Geoffrey P. Webb: Dietary supplements and functional foods. Wiley-Blackwell, 2006, ISBN 978-1-4051-1909-2. S. 196.
- ↑ Habermehl, Hammann, Krebs: Naturstoffchemie. Eine Einführung. 2. Auflage. Springer, Berlin 2002, ISBN 978-3-540-43952-3.
- ↑ 23,0 23,1 Claus Leitzmann et al.: 21. Vitamin B12 (Cobalamin). In: Ernährung in Prävention und Therapie: ein Lehrbuch. 2. Auflage. Georg Thieme Verlag, 2003, ISBN 978-3-8304-5273-7. S. 51.
- ↑ Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Vitamin B12. In: Pharmakotherapie bei Haus- und Nutztieren. 7. Auflage. Georg Thieme Verlag, 2006, ISBN 978-3-8304-4160-1. S. 346.
- ↑ Hans-Konrad Biesalski, Stephan C. Bischoff, Christoph Puchstein (Hrsg.): 11.4 Cobalt. In: Ernährungsmedizin: nach dem neuen Curriculum Ernährungsmedizin der Bundesärztekammer. 4. Auflage. Georg Thieme Verlag, 2010, ISBN 978-3-13-100294-5. S. 205.
- ↑ bfr.bund.de: Verwendung von Vitaminen in Lebensmitteln (PDF-Datei; 1,3 MB), S. 212.
- ↑ 27,0 27,1 W. J. Craig, A. R. Mangels; American Dietetic Association: Position of the American Dietetic Association: vegetarian diets. In: Journal of the American Dietetic Association. Band 109, Nummer 7, S. 1266-1282 (Juli 2009). PMID 19562864 Volltext (PDF; 644 kB).
- ↑ Fumio Watanabe, Yukinori Yabuta, Tomohiro Bito, Fei Teng: Vitamin B₁₂-containing plant food sources for vegetarians. In: Nutrients., Mai 2014; 6(5): 1861–1873. doi:10.3390/nu6051861 PMID 24803097.
- ↑ Humanmilch. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2013.
- ↑ 30,0 30,1 Berthold Koletzko, Franziska Feldl: Ausgewogene Substratversorgung durch Fleischverzehr In: Dtsch Arztebl 1998; 95(11): A-606 / B-494 / C-466. Volltext.
- ↑ Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline: 9. Vitamin B12 In: Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline., National Academies Press, Washington D.C. 1998; S. 324. ISBN 978-0-309-06411-8. Online.
- ↑ Ralph Carmel, Yash Pal Agrawal: Failures of Cobalamin Assays in Pernicious Anemia. In: New England Journal of Medicine 2012; 367: 385-386.
- ↑ 33,0 33,1 Wolfgang Herrmann, Rima Obeid: Causes and Early Diagnosis of Vitamin B12 Deficiency. In: Deutsches Ärzteblatt 2008; Band 105, Heft 40, S. 680–685 doi:10.3238/arztebl.2008.0680.
- ↑ F. v. d. Berg, L. Gifford, J. Cabri, L. Arendt-Nielsen, E. Bader: Angewandte Physiologie: Organsysteme verstehen und beeinflussen. 2. Auflage. Thieme, 2005, ISBN 978-3-13-117082-8, S. 236.
- ↑ O. Braun-Falco, H. Lincke: The problem of vitamin B6/B12 acne. A contribution on acne medicamentosa In: Münchener medizinische Wochenschrift, 1976, Bd 118, S. 155–160. PMID 130553.
- ↑ Cyanokit(R) von Merck Serono in der Europäischen Union zugelassen. Pressemitteilung vom 29. November 2007.
- ↑ Wolfgang Uhl, Arno Nolting, Georg Golor, Karl Ludwig Rost, Andreas Kovar: Safety of Hydroxocobalamin in Healthy Volunteers in a Randomized, Placebo-Controlled Study. In: Clinical Toxicology. 44, 2006, S. 17–28, doi:10.1080/15563650600811755.
- ↑ Stücker, M. et al. (2001): Vitamin B12 Cream Containing Avocado Oil in the Therapy of Plaque Psoriasis. In: Dermatology. Bd. 203, S. 141–147; PMID 11586013; doi:10.1159/000051729; Volltext, PDF-Datei, 2,7 MB.
- ↑ Stücker, M. et al. (2004): Topical vitamin B12 - a new therapeutic approach in atopic dermatitis-evaluation of efficacy and tolerability in a randomized placebo-controlled multicentre clinical trial. In: British Journal of Dermatology. Bd. 150, Nr. 5, S. 977–983; PMID 15149512; doi:10.1111/j.1365-2133.2004.05866.x; Volltext, PDF-Datei, 3,3 MB.
- ↑ R. Januchowski: Evaluation of topical vitamin B(12) for the treatment of childhood eczema. In: Journal of alternative and complementary medicine (New York, N.Y.). Band 15, Nummer 4, April 2009, S. 387–389, doi:10.1089/acm.2008.0497. PMID 19368512.
- ↑ Köppelle, Winfried (2009): Schleichwerbung für Quacksalbe und Wunderbuch. Laborjournal, November 2009, 68-70. Volltext-Version
- ↑ 42,0 42,1 Jochen Niehaus: Zu dick aufgetragen In: Focus Online vom 26. Oktober 2009 (zuletzt abgerufen am 16. November 2009).
- ↑ Frankfurter Allgemeine: Schuppenflechte-Therapie - Rosarot ist die Hoffnung
- ↑ Öko-Test: Neurodermitis-Creme - Falsche Heilsversprechen.
- ↑ NDR, Magazin ZAPP vom 28. Oktober 2009.
- ↑ Internetseite der Regeneration Pharma GmbH, Namensänderung unserer Vitamin B12 Salbe (Memento vom 18. Februar 2012 im Internet Archive), abgerufen über archive.org, Stand vom 18. Februar 2012.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Cobalamine aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |