| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Sulforaphan
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
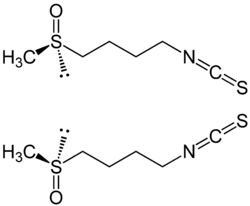
| |||||||
| (R)-Sulforaphan (oben) und (S)-Sulforaphan (unten) | |||||||
| Allgemeines | |||||||
| Name | Sulforaphan | ||||||
| Andere Namen |
| ||||||
| Summenformel | C6H11NOS2 | ||||||
| CAS-Nummer |
| ||||||
| PubChem | 5350 | ||||||
| Kurzbeschreibung |
leicht gelbliche Flüssigkeit[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 177,29 g·mol−1 | ||||||
| Siedepunkt | |||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Sulforaphan, chemisch 1-Isothiocyanato-4-methylsulfinyl-butan, ist ein Isothiocyanat. Das Senföl entsteht bei der enzymatischen Hydrolyse des Senfölglykosids Glucoraphanin.
Eigenschaften und Vorkommen
Sulforaphan ist ein starkes indirektes Antioxidans.[3] Es wurde erstmals 1992 von Paul Talalay und Kollegen an der Johns-Hopkins-Universität in Baltimore isoliert und beschrieben.[4]
Der sekundäre Pflanzenstoff kommt als Senfölglykosid-Glucoraphanin insbesondere in Kreuzblütengewächsen wie Kohl und Broccoli vor. Im Unterschied zu Vitamin C, Vitamin E oder β-Carotin neutralisiert der Wirkstoff freie Radikale nicht direkt, sondern indirekt, indem es Phase-II-Enzyme aktiviert. Hierdurch werden nachhaltige antioxidative Abwehrmechanismen des Körpers in Gang gesetzt.[5]
In verschiedenen Studien konnte sowohl in der Zellkultur als auch in Tierversuchen eine Tumorzellen hemmende Wirkung von Sulforaphan nachgewiesen werden. Hierbei sollen bestimmte Komponenten von sich teilenden Krebszellen, die sogenannten Mikrotubuli, von Sulforaphan zerstört werden, was zum Niedergang der Krebszelle führt. Derzeit (Stand September 2012) befindet sich Sulforaphan in einer Vielzahl klinischer Studien.[6] So unter anderem in einer Phase-II-Studie zur Behandlung des Prostatakarzinoms.[7]
In neueren experimentellen Studien (2011) vom Universitätsklinikum Heidelberg und Deutschen Krebsforschungszentrum konnte gezeigt werden, dass der Inhaltsstoff Sulforaphan aus Broccoli und verwandtem Gemüse das Krebswachstum von Bauchspeicheldrüsenkrebs hemmen kann und die Wirkung von Chemotherapien verstärkt. Sulforaphan blockiert hierbei einen bestimmten Stoffwechselweg in Krebsstammzellen, was erstmals in Versuchen an Krebszellen und Mäusen gezeigt werden konnte.[8] Nach einer kanadischen Studie soll bei Patienten mit Prostatakarzinom der wöchentliche Verzehr von Broccoli oder Blumenkohl die Metastasierung des Tumors um 50 Prozent verringern.[9] Zudem soll der Wirkstoff keimtötend gegen den Magengeschwür-Verursacher Helicobacter pylori wirken, auch gegen Stämme, die gegen gängige Antibiotika Resistenzen gebildet haben.[10][11][12]
Metabolismus

Der Abbau und die Ausscheidung von Sulforaphan geschieht in Säugetieren hauptsächlich mittels einer Glutathion-S-Transferase, indem es zu einem Dithiocarbamat umgesetzt wird, dabei wird die Thiolgruppe des Glutathions an die Isothiocyanatgruppe des Sulforaphans addiert. Nach der enzymatischen Abspaltung der Glutaminsäure und des Glycins wird durch Acetylierung ein N-Acetylcystein-Addukt gebildet, welches in Tierversuchen an Ratten (zusammen mit dem Glutathion-Addukt) in Urin und Galle gefunden werden konnte. Sulforaphan kann auch zu seinem Thioether-Analogon Erucin reduziert werden, die genauen Mechanismen dazu sind bislang noch ungeklärt.[13]
Literatur
- B. M. Kaminski, D. Steinhilber u. a.: Phytochemicals resveratrol and sulforaphane as potential agents for enhancing the anti-tumor activities of conventional cancer therapies. In: Current Pharmaceutical Biotechnology. Band 13, Nummer 1, Januar 2012, S. 137–146, PMID 21466425. (Review).
- Y. S. Keum: Regulation of the Keap1/Nrf2 system by chemopreventive sulforaphane: implications of posttranslational modifications. In: Annals of the New York Academy of Sciences. Band 1229, Juli 2011, S. 184–189, doi:10.1111/j.1749-6632.2011.06092.x. PMID 21793854. (Review).
- C. W. Beecher: Cancer preventive properties of varieties of Brassica oleracea: a review. In: The American journal of clinical nutrition. Band 59, Nummer 5 Suppl, 1994, S. 1166S–1170S, PMID 8172118. (Review). PDF (freier Volltextzugriff, auf Englisch)
- C. Fimognari, P. Hrelia: Sulforaphane as a promising molecule for fighting cancer. In: Mutation Research. Band 635, Nummer 2–3, 2007, S. 90–104, doi:10.1016/j.mrrev.2006.10.004. PMID 17134937. (Review).
- N. Juge, R. F. Mithen, M. Traka: Molecular basis for chemoprevention by sulforaphane: a comprehensive review. In: Cellular and molecular life sciences. Band 64, Nummer 9, 2007, S. 1105–1127, doi:10.1007/s00018-007-6484-5. PMID 17396224. (Review).
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 Datenblatt DL-Sulforaphane bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- ↑ Senföle. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ C. E. Guerrero-Beltrán, M. Calderón-Oliver u. a.: Protective effect of sulforaphane against oxidative stress: recent advances. In: Experimental and Toxicologic Pathology. Band 64, Nummer 5, Juli 2012, S. 503–508, doi:10.1016/j.etp.2010.11.005. PMID 21129940.
- ↑ Y. Zhang, P. Talalay u. a.: A major inducer of anticarcinogenic protective enzymes from broccoli: isolation and elucidation of structure. In: PNAS. Band 89, Nummer 6, März 1992, S. 2399–2403, PMID 1549603. PMC 48665 (freier Volltext).
- ↑ Y. Zhang, T. W. Kensler u. a.: Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates. In: PNAS. Band 91, Nummer 8, April 1994, S. 3147–3150, PMID 8159717. PMC 43532 (freier Volltext).
- ↑ clinicaltrials.gov: Sulforaphane. abgerufen am 25. September 2012.
- ↑ Vorlage:Clinicaltrials
- ↑ G. Kallifatidis, S. Labsch u. a.: Sulforaphane increases drug-mediated cytotoxicity toward cancer stem-like cells of pancreas and prostate. In: Molecular therapy. Band 19, Nummer 1, Januar 2011, S. 188–195, doi:10.1038/mt.2010.216. PMID 20940707. PMC 3017446 (freier Volltext).
- ↑ Annette Tuffs: Preisgekrönte Forschungsergebnisse: Wie Brokkoli-Wirkstoffe die Krebstherapie unterstützen. Universitätsklinikum Heidelberg, Pressemitteilung vom 12. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- ↑ J. K. Moon, J. R. Kim u. a.: Analysis and anti-Helicobacter activity of sulforaphane and related compounds present in broccoli (Brassica oleracea L.) sprouts. In: Journal of agricultural and food chemistry. Band 58, Nummer 11, Juni 2010, S. 6672–6677, doi:10.1021/jf1003573. PMID 20459098.
- ↑ J. W. Fahey, X. Haristoy u. a.: Sulforaphane inhibits extracellular, intracellular, and antibiotic-resistant strains of Helicobacter pylori and prevents benzo[a]pyrene-induced stomach tumors. In: PNAS. Band 99, Nummer 11, Mai 2002, S. 7610–7615, doi:10.1073/pnas.112203099. PMID 12032331. PMC 124299 (freier Volltext).
- ↑ X. Haristoy, K. Angioi-Duprez u. a.: Efficacy of sulforaphane in eradicating Helicobacter pylori in human gastric xenografts implanted in nude mice. In: Antimicrobial agents and chemotherapy. Band 47, Nummer 12, Dezember 2003, S. 3982–3984, PMID 14638516. PMC 296232 (freier Volltext).
- ↑ Ann Liza Piberger: Untersuchungen zum Einfluss von Sulforaphan auf die DNA-Einzelstrangbruch- und Nukleotidexzisionsreparatur. 2014-02-13 S. 5-9, doi:10.5445/IR/1000043295.
Weblinks
- sciencedaily.com: UIC Researchers Show How Cancer-Preventing Foods Work, 13. Juli 2005 (engl.)
| Dieser Artikel basiert ursprünglich auf dem Artikel Sulforaphan aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |