| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Benzol
| Strukturformel | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||
| Allgemeines | |||||||||||
| Name | Benzol | ||||||||||
| Andere Namen |
Benzen (IUPAC) | ||||||||||
| Summenformel | C6H6 | ||||||||||
| CAS-Nummer | 71-43-2 | ||||||||||
| PubChem | 241 | ||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[1] | ||||||||||
| Eigenschaften | |||||||||||
| Molare Masse | 78,11 g·mol−1 | ||||||||||
| Aggregatzustand |
flüssig | ||||||||||
| Dichte |
0,88 g·cm−3[1] | ||||||||||
| Schmelzpunkt | |||||||||||
| Siedepunkt |
80,1 °C[1] | ||||||||||
| Dampfdruck | |||||||||||
| Löslichkeit |
schlecht in Wasser (1,77 g·l−1)[1] | ||||||||||
| Brechungsindex |
1,5011[2] | ||||||||||
| Sicherheitshinweise | |||||||||||
| |||||||||||
| MAK |
nicht festgelegt, da krebserregend[1] | ||||||||||
| Toxikologische Daten | |||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||
Benzol (auch Benzen) ist eine flüssige organische Verbindung mit einem charakteristischen aromatischen Geruch. Die Verbindung mit der Summenformel C6H6 ist ein aromatischer Kohlenwasserstoff und das einfachste und zugleich klassische Beispiel für die Aromatizität bestimmter Verbindungen. Benzol ist mischbar mit fast allen organischen Solventien, jedoch kaum mit Wasser. Als Lösungsmittel hat Benzol seine Bedeutung verloren, da es krebserregend ist.
Benzol wird zur Herstellung wichtiger Industriechemikalien wie Ethylbenzol, Cumol, Cyclohexan, sowie Nitrobenzol verwendet.[5]
Benzol ist in Motorenbenzin enthalten. In Deutschland und der EU sind nach EN 228 nur noch maximal ein Prozent erlaubt;[6] in den USA ist ebenfalls maximal ein Prozent zulässig.[7]
Geschichte
Der Name Benzol wurde im Jahr 1843 erstmals von Justus von Liebig gebraucht. Liebig änderte die Namensgebung von Eilhard Mitscherlich von 1833, der das Benzol als Benzin bezeichnet hatte, um.[8] Im angelsächsischen und französischen Sprachbereich wurde die adaptierte Bezeichnung (franz: benzène, engl: benzene) von Mitscherlich jedoch weiterhin benutzt.
In der 2. Hälfte des 17. Jahrhunderts wurde Benzol von Johann Rudolph Glauber, der auch das Glaubersalz entdeckte, bei der Destillation von Steinkohleteer entdeckt. Die Zusammensetzung war für ihn jedoch unbekannt und so nannte er es ein „subtiles und liebliches Oleum“. Im Jahre 1825 wurde Benzol von dem englischen Physiker Michael Faraday im Leuchtgas entdeckt, nämlich dadurch, dass er dieses Öl aus flüssigen Rückständen isolierte, die sich beim Verbrennen von Walölen in den Londoner Straßenlaternen aus der Gasphase abschieden. Er schlug deshalb den Namen „Pheno“ (gr. phainein = leuchten) vor. Ein Jahr später erkannte man dieses Öl als Kohlenwasserstoff. Im Jahre 1834 erhielt der deutsche Chemiker Eilhard Mitscherlich Benzol aus Benzoesäure und Calciumoxid, des Weiteren setzte er Benzol zu Nitrobenzol, Azobenzol und Benzolsulfonsäure um. Er benannte den Stoff wegen seiner Verwandtschaft zu Benzoesäure als „Benzin“. Außerdem erstellte er die richtige Summenformel C6H6. Im gleichen Jahr wurde „Benzin“ von Justus von Liebig in Benzol umbenannt. 1845 isolierte der englische Chemiker Charles Mansfield während seiner Arbeit unter Leitung von August Wilhelm von Hofmann Benzol aus Steinkohleteer.
Um die korrekte Strukturformel des Benzols schwelte ein langer Gelehrtenstreit. Erste Vorschläge wie die Prisman-Struktur, die des Benzvalen, des Dicyclopropenyl sowie das Dewar-Benzol (von James Dewar) stellten sich als falsch heraus. Erst im Jahre 1861 formulierte der österreichische Chemiker Johann Josef Loschmidt, damals noch Schullehrer, einige mögliche Strukturformeln des Benzols, die der deutsche Chemiker und Professor für Chemie August Kekulé dann 1865 – möglicherweise als Anregung für seine Kekulé-Strukturformel (siehe rechte untere Abbildung) – übernahm. Einer Legende nach kam Kekulé dieser Einfall im Traum. Er träumte von einer Schlange, die sich selbst in den Schwanz biss. Kekulé beschreibt dies in seiner Rede zum 25-jährigen Jubiläum des Benzolrings 1890. Die sechs Affen, die sich abwechselnd entweder mit beiden oder mit einer Hand an den Füßen fassten und so die Ringstruktur bildeten, beruhen auf einem 1886 bei einem Bierabend der Deutschen Chemischen Gesellschaft gemachten Scherz.[9]
Kekulés Struktur trug als erste dem experimentellen Befund Rechnung, dass im Benzol alle Kohlenstoffatome gleichwertig sind. Allerdings konnten damit noch nicht alle Besonderheiten des Benzols erklärt werden, wie beispielsweise seine ungewöhnlich niedrige Reaktivität. Rätselhaft war insbesondere das Ausbleiben einer Additionsreaktion mit Bromwasser, wie sie nach der Kekulé-Strukturformel eigentlich zu erwarten wäre. Der Beweis der Gleichwertigkeit der Wasserstoffe im Benzolmolekül konnte von 1869 bis 1874 erbracht werden. Im Jahre 1872 formulierte Kekulé seine Oszillationshypothese eines dauernden Platzwechsels von Einfach- und Doppelbindungen.
Vorgeschlagene Strukturformeln 



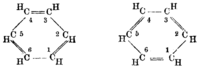
Von Adolf Karl Ludwig Claus (1867) Von James Dewar (1867) Von Albert Ladenburg (1869) Von Henry Edward Armstrong (1887),
Adolf von Baeyer (1888)Von Friedrich Karl Johannes Thiele (1899) Von August Kekulé (1872)
Erst im 20. Jahrhundert konnte das Phänomen der delokalisierten Elektronenwolken, die dem Benzolmolekül eine besondere Stabilität verleihen, über Röntgenstrukturanalyse nachgewiesen werden. 1925 führten Armit und Robinson die vereinfachte Schreibweise mit dem konzentrischen Kreis in der Formel ein, welcher zum Ausdruck bringen soll, dass alle Bindungen absolut gleichwertig sind und keine lokalisierbaren Doppelbindungen existieren.[10]
Im Jahr 1849 begann die industrielle Herstellung des Benzols auf der Basis von Steinkohle. Es wurde sorglos mit ihm umgegangen, bis Kampagnen schließlich über 100 Jahre später über die Gefahren des Benzols aufklärten, als die Giftigkeit des Benzols bekannt wurde.
Strukturformel und Nomenklatur
Benzol ist der einfachste der benzoiden aromatischen Kohlenwasserstoffe, die auch Arene genannt werden. Die besonderen Bindungsverhältnisse dieser Stoffgruppe werden Aromatizität genannt und hier anhand des Benzols als Prototyp der Arene beschrieben:
Jedes Kohlenstoffatom verfügt über vier Valenzelektronen, von denen zwei das Atom mit den benachbarten C-Atomen verbinden. Ein Elektron bindet das zugehörige Wasserstoffatom. Die verbleibenden sechs π-Elektronen ergeben formal drei π-Bindungen, wie sie in der Strukturformel mit drei Doppelbindungen ausgedrückt wurden. In dem heute gültigen Orbitalmodell bilden die sechs π-Elektronen eine delokalisierte Ladungswolke (delokalisiertes 6-π-Elektronensystem) über und unter der Ebene des Kohlenstoffrings.

|
| Mesomerie des Benzols. Die delokalisierten π-Elektronen sind energetisch günstiger als die Grenzstrukturen mit lokalisierten Doppelbindungen. Mesomerieenergie EM (Resonanzenergie) |
Kekulé drückte diesen Umstand der Mesomerie durch zwei Strukturformeln aus, die jeweils nur die beiden Extrempunkte der Ladungswolke symbolisieren. Aufgrund der Mesomerie ist der Kohlenstoffring stabiler als das hypothetische Cyclohexatrien mit lokalisierten Doppelbindungen an festgelegten Positionen. In der vereinfachten Schreibweise wird der Kohlenstoffring heute als Sechseck und die Elektronenwolke als einbeschriebener Kreis dargestellt. Benzol ist ein planares Molekül, bei dem die Kohlenstoffatome alle sp2-hybridisiert sind. Die Delokalisierung der Elektronen begründet die Äquivalenz aller CH-Gruppierungen im Molekül und damit die hohe Symmetrie[11], weswegen Benzol der Punktgruppe D6h angehört, also mit einer sechszähligen Achse versehen ist.[12] Der Einfluss des π-Elektronensystems auf die Struktur ist jedoch nicht unumstritten.[13] Im Sommer 2013 gelang es Forschern des Lawrence Berkeley National Laboratory mit einem Rasterkraftmikroskop die hexagone Molekülgeometrie des Benzols nachzuweisen und fotografisch darzustellen.[14][15] Da in der systematischen chemischen Nomenklatur die Endung -ol für Alkohole verwendet wird, ist die im Deutschen meist verwendete, historisch bedingte Bezeichnung Benzol irreführend; der Name Benzen wurde von der IUPAC als offizielle Nomenklatur für diesen Kohlenwasserstoff bestimmt.
Vorkommen und Benzolemissionen
Kleinere Mengen an Benzol kommen im Erdöl vor. Beim Rauchen von Zigaretten werden kleine Mengen Benzoldampf (10–100 µg pro Zigarette) freigesetzt, auch bei Vulkanausbrüchen und Waldbränden sowie bei unvollständiger Verbrennung von organischem Material entstehen Spuren von Benzol. In der Atmosphäre wird nach zwei bis fünf Tagen die Hälfte des vorhandenen Benzols abgebaut, da dieses mit Hydroxyl-Radikalen (freie OH-Gruppen) reagiert. Hauptsächlich wird Benzol durch Abgase von Benzinmotoren freigesetzt. 75 Prozent der Emissionen gehen auf Kraftfahrzeuge zurück. Der Benzolanteil des Motorenbenzins ist ab dem Jahr 2000 europaweit nach DIN EN 228 auf maximal ein Volumenprozent begrenzt worden; der Durchschnitt im Jahre 2003 betrug ~0,7 Volumenprozent. Der aktuelle Grenzwert liegt derzeit (2010) in den USA bei fünf Volumenprozent.[7][16] Ab 2013 soll der US-Durchschnitt des Benzolanteils im Benzin zwar auf 0,62 Prozent[17] reduziert werden, eine Begrenzung des Maximalanteils unter fünf Prozent ist aber immer noch nicht vorgesehen.[18]
Die durchschnittliche Belastung der Bevölkerung beträgt im Mittel circa 2 µg/m3 Luft, dieser Wert kann je nach Umgebung jedoch wesentlich höher sein (zum Beispiel an Tankstellen, in schlecht belüfteten Garagen etc.). Um 1980 gab es einen starken Rückgang der Benzolemissionen, der sich in den 1990er Jahren fortsetzte. So reduzierte sich die Benzolbelastung zwischen 1997 und 2005 sowohl an den städtischen, verkehrsnahen Messstationen als auch an den städtischen Hintergrundstationen erheblich, so dass schon im Jahr 2005 die erst seit dem Jahr 2010 geltenden Grenzwerte von 5 µg/m3 unterschritten wurden.[19]
Herstellung
Benzol kann durch Steamcracken oder katalytisches Reforming von Naphtha gewonnen werden. Hierbei wird meist Hexan zu Cyclohexan und dann zu Benzol dehydriert. Ein weiteres Verfahren zur Benzolherstellung ist die thermische Entalkylierung. Hierbei wird bei 780 °C und einem Druck von 40 bar die Methylgruppe des eingesetzten Toluols abgespalten. Trägergas im Reaktor ist hierbei 90-prozentiger Wasserstoff. Nach Abkühlung und der Gas-Flüssigkeits-Trennung sowie Reinigung wird so Reinstbenzol gewonnen. Auch aus Ethinmolekülen lässt sich in Anwesenheit eines Katalysators Benzol herstellen, was nach dem deutschen Chemiker Walter Reppe als Reppe-Chemie bezeichnet wird.[20]
Von ungefähr 1930 bis 1960 entstand das meiste Benzol als Nebenprodukt bei der Erzeugung von Leuchtgas auf Basis von Steinkohle. Für die Suche nach Verwertungsmöglichkeiten wurde schon 1918 der Benzol-Verband gegründet. Es erwies es sich als geeigneter Benzinzusatz, um dessen Klopffestigkeit zu erhöhen; so entstand das „Super“-Benzin aus aromatischen und aliphatischen Bestandteilen und führte zum Unternehmensnamen B. V. ARAL. Seit 1950 wird es auch aus Erdöl gecrackt. 1992 wurden in Westeuropa rund 90 Prozent des Benzols aus Erdöl gewonnen, (65 Prozent aus Pyrolysebenzin, 17 Prozent aus Reformatbenzin, neun Prozent durch Entalkylierung) und zehn Prozent aus Kohle und Kohlenteer. Jährlich werden weltweit etwa 35 Millionen Tonnen Benzol hergestellt.
Derzeit legen Produktion und Verbrauch von Benzol im Mittleren Osten am stärksten zu. Man rechnet dort bis zum Jahr 2018 mit einem Anwachsen des Anteils am Weltmarkt von 3,7 und 3,3 Prozentpunkten bei Angebot bzw. Nachfrage. Die Region Asien-Pazifik wird jedoch auch in Zukunft den Markt dominieren und fast die Hälfte der globalen Nachfrage generieren. China wird zum weltweit größten Benzol-Verbraucher aufsteigen und voraussichtlich im Jahr 2014 die USA auf Rang zwei verweisen.[21]
Eigenschaften
Physikalische Eigenschaften
Benzol ist eine farblose, klare, mit einem Brechungsindex von 1,5011 stark lichtbrechende, leicht flüchtige und leicht brennbare Flüssigkeit. Der Brechungsindex von Benzol stimmt recht gut mit dem von Fensterglas überein. Ein Glasstab, der in Benzol eingetaucht ist, ist daher nahezu unsichtbar (siehe auch Immersionsmethode (Mineralogie)). Die Viskosität des Benzols ist geringer als die des Wassers (es ist dünnflüssiger). Es erstarrt bei 5,5 °C und siedet bei 80,1 °C. Bei Zimmertemperatur (20 °C) hat es eine Dichte von 0,88 Kilogramm pro Liter und einen Dampfdruck von 110 hPa. Die Eigenschaften von Reinbenzol sind durch die DIN-Norm 51633 festgelegt.
Mit unpolaren, organischen Lösungsmitteln wie Ether ist Benzol in jedem Verhältnis unbegrenzt mischbar, mit Wasser jedoch nur schlecht (maximal 1,7 Gramm Benzol pro Liter).
Eine Besonderheit ist, dass Benzol sechs gleich lange Bindungen von 139 pm besitzt. Dieser Wert liegt zwischen dem für eine Einfachbindung und eine Doppelbindung und ist ein Kennzeichen für den aromatischen Charakter von Benzol.
Der thermische Ausdehnungskoeffizient γ flüssigen Benzols beträgt bei 20 °C 0,001187 K−1.
Sicherheitstechnische Kenngrößen
Die Verbindung hat einen Flammpunkt bei −11 °C.[22] Benzol bildet leicht entzündliche Dampf-Luft-Gemische. Der Explosionsbereich liegt zwischen 1,2 Volumenprozent (39 g/m3) als untere Explosionsgrenze (UEG) und 8,6 Volumenprozent (280 g/m3) als obere Explosionsgrenze (OEG).[22] Die Grenzspaltweite wurde mit 0,99 mm bestimmt.[22] Es resultiert damit eine Zuordnung in die Explosionsklasse IIA.[1] Die Mindestzündenergie liegt bei 0,2 mJ.[22] Damit können auch energetisch schwächere Zündquellen wie Büschelentladungen und Schleif- bzw. Schlagfunken eine Entzündung von Dampf-Luft-Gemischen innerhalb der Explosionsgrenzen bewirken. Die Zündtemperatur beträgt 555 °C.[22] Der Stoff fällt somit in die Temperaturklasse T1.
Chemische Eigenschaften
Benzol verbrennt mit gelber Flamme zu Wasser und Kohlendioxid, wobei die starke Rußentwicklung auf den hohen Kohlenstoffanteil der Verbindung hinweist. Der Heizwert des Benzols beträgt 40.580 kJ/kg, die Verbrennungsenthalpie 3257,6 kJ/mol bei flüssigem Benzol und 3301 kJ/mol bei gasförmigem. Benzol hat einen charakteristischen Geruch. Die Geruchsschwelle ist sehr niedrig und liegt bei 1,5 bis 900 Milligramm pro Kubikmeter Luft.
Reaktionen
Datei:Benzol + Brom.ogv Radikalische Substitutionen am Benzol finden im Vergleich zu Alkenen aufgrund der Stabilisierung durch die Aromatizität nicht statt. Ausnahme bildet hierbei die so genannte Sandmeyer-Reaktion, bei der aus Diazoniumsalzen in einer durch Kupfer katalysierten homolytischen Abspaltung von molekularem Stickstoff ein Phenyl-Radikal entsteht. Dieses ist aber hochreaktiv und reagiert sofort weiter.
Ein wichtiges Merkmal der Aromatizität von Benzol ist das Ausbleiben einer Additionsreaktion mit Bromwasserstoffsäure oder Bromwasser.
Vollständige Oxidation (Verbrennung) des Benzols:
- Mit Sauerstoff reagiert Benzol zu Kohlenstoffdioxid und Wasser.
Beispiel für eine Elektrophile aromatische Substitutionsreaktion (Nitrierung):
- Mit Salpetersäure reagiert Benzol (in Gegenwart des Katalysators Schwefelsäure) zu Wasser und Nitrobenzol.
Beispiel für eine Radikalische Additionsreaktion (Chlorierung):
Benzolderivate
Viele wichtige Chemikalien sind Derivate des Benzols, haben also einen Benzolring als Grundgerüst. Dazu gehören beispielsweise Verbindungen mit Alkylgruppen, wie Toluol und die Xylole (Benzolhomologe[23]) Technisch bedeutend sind Ethylbenzol und Cumol, sowie Styrol mit einer Alkenylgruppe.
Wichtige Verbindungen mit funktionelle Gruppen sind Phenol mit einer Hydroxygruppe (–OH), Anilin mit einer Aminogruppe (–NH2), Benzoesäure mit einer Carboxygruppe (–COOH), sowie Chlorsubstituierte Benzole.
Benzol als Ligand
Bis heute wurden in der metallorganischen Chemie viele Komplexe synthetisiert, die Benzol als Ligand enthalten. Die bekannteste Verbindung ist wohl das erstmals 1955 von Ernst Otto Fischer und Walter Hafner dargestellte Bis(benzol)chrom, ein sogenannter Sandwichkomplex.
Spektroskopische Eigenschaften
Im 1H-NMR-Spektrum zeigen die Wasserstoffatome eine ungewöhnlich starke Entschirmung (Singulett bei 7,28 ppm in CDCl3 für alle sechs Wasserstoffatome), die durch den vom Magnetfeld des Spektrometers induzierten Ringstrom verursacht wird.
Im 13C-NMR-Spektrum zeigt Benzol in CDCl3 ein Signal bei 128,5 ppm für alle sechs Kohlenstoffatome.
Im IR-Spektrum erscheint die Phenyl-Wasserstoffschwingung bei etwa 3.035 cm−1. Die C–C-Valenzschwingung erscheint bei 1.500 bis 2.000 cm−1. Bei 650 bis 1.000 cm−1 befinden sich die C–H-Deformationsschwingungen.
UV-spektroskopisch lässt sich Benzol noch in hoher Verdünnung an zwei typischen Absorptionen (π-π* Übergänge) im Bereich von 200 bis ca. 250 nm nachweisen.
Verwendung
Benzol wird in der Petrochemie für die Synthese vieler Verbindungen gebraucht, vorwiegend Ethylbenzol (52 Prozent), Cumol (20 Prozent), Cyclohexan (13 Prozent) und Nitrobenzol (neun Prozent)[24]. Diese Verbindungen sind, wie die Abbildung rechts zeigt, wiederum Ausgangsstoffe zur Synthese von Verbindungen, wie Styrol, Phenol, Aceton, Cyclohexanol, Cyclohexanon und Anilin. Auf ihnen basieren Kunststoffe, wie Polystyrol, Styrol-Butadien-Kautschuk, Polyamide (Nylon) und Epoxidharze. Viele weitere Produkte, wie waschaktive Stoffe (Alkylbenzolsulfonsäuren), technische Lösemittel, bestimmte Pestizide (beispielsweise Lindan) und Farbstoffe basieren auf Benzol bzw. auf den Folgeprodukten.
Aufgrund der schwerwiegenden Gefahren darf in Deutschland Benzol und benzolhaltige Zubereitungen mit über 0,1 Prozent nicht in den Verkehr gebracht werden.[25] In größeren Mengen darf es nur in geschlossenen Systemen und zu industriellen oder Forschungszwecken verwendet werden. Eine Ausnahme bilden hier Treibstoffe: Benzol erhöht die Klopffestigkeit von Benzin, weshalb es in der Entwicklung der Ottokraftstoffe eine wichtige Rolle einnahm. Einige frühe Lokomotiven mit Verbrennungsmotor benutzen einen Treibstoff, der hauptsächlich aus Benzol bestand. Heute ist es nur noch als Kraftstoffzusatz in einer Konzentration bis zu einem Prozent zulässig.
Früher wurde Benzol als gutes Lösungs- und Reinigungsmittel in vielen Bereichen verwendet. Als Lösungsmittel für Wachse, Harze und Öle wird Benzol zunehmend durch weniger giftige Stoffe wie das nichtkarzinogene Toluol verdrängt.
Toxikologie
Benzoldämpfe sind beim Einatmen giftig; die Symptome akuter Vergiftungen treten erst bei relativ hohen Konzentrationen ein. Leichte Vergiftungen äußern sich in Schwindelgefühl, Brechreiz, Benommenheit und Apathie. Bei einer schweren Vergiftung kommt es zu Fieber und Sehstörungen bis hin zu vorübergehender Erblindung und Bewusstlosigkeit. Bei der so genannten Benzolsucht, die beim Einatmen von Benzol eintreten kann, kommt es zu Trunkenheits- und Euphoriegefühlen. Benzol kann bei längerer Einwirkung auf den Organismus zum Tod führen.
Die Giftwirkung ebenso wie die karzinogene Wirkung ist auf die Bildung eines karzinogenen Metaboliten zurückzuführen. Im Körper wird Benzol enzymatisch am Ring oxidiert. Das entstehende hochreaktive Epoxid (Arenoxid) reagiert mit zahlreichen biologischen Verbindungen und kann auch das Erbgut schädigen bzw. Protein-Addukte bilden. Das Arenoxid wird weiter zu Phenol metabolisiert. Durch Hydrolasen kann das hochreaktive Arenoxid auch zum trans-1,2-Dihydrobenzol-1,2-diol weiter reagieren. Außerdem kann das Arenoxid reversibel zum Oxepin umlagern. Diese Weiterreaktionen verlaufen nicht-enzymatisch.[26] Eine langzeitige Aufnahme kleinerer Benzolmengen führt vor allem zu Schädigungen der inneren Organe und des Knochenmarks. Letzteres resultiert in einer Abnahme der Zahl der roten Blutkörperchen (Anämie), was sich in Herzklopfen, Augenflimmern, Müdigkeit, Schwindel, Blässe und Kopfschmerzen äußert. Benzol wird im Gehirn, Knochenmark und Fettgewebe gespeichert. Es wird nur langsam über die Niere ausgeschieden. Der Abbau erfolgt über verschiedene Umbauprodukte wie das Brenzcatechin, Phenol, Hydrochinon und Benzochinon. Das Hauptausscheidungsprodukt ist schließlich die Phenylmercaptursäure (N-Acetyl-S-phenyl-cystein).
Bei zwei Prozent Luftvolumenanteil Benzol in der Atemluft kommt es nach fünf bis zehn Minuten zum Tod. Die akute letale Dosis (oral) beträgt beim Menschen 50 Milligramm pro Kilogramm Körpergewicht. Zwischen einem Luftvolumenanteil von 1,4 bis 8 Prozent bildet Benzol explosive Gemische.
Benzol ist aufgrund dieser Gefahren mit besonderer Vorsicht zu handhaben. Benzol muss bei 15 °C bis 25 °C gelagert werden. Der TRK-Wert lag bei 1 Milliliter pro Kubikmeter Luft (bzw. 3,25 mg/m3 Luft). Jede Exposition gegenüber Benzol sollte möglichst vermieden oder verringert werden; vor dem Gebrauch von Benzol sind besondere Anweisungen einzuholen. Bei Unfall oder Unwohlsein sollte sofort ein Arzt hinzugezogen werden. Orte, an denen Benzol austritt oder austreten könnte, sollten sofort verlassen und nur in Vollschutzanzügen wieder betreten werden. Benzol ist stark wassergefährdend.
Isobenzol
Das extrem kurzlebige Allen Cyclohexa-1,2,4-trien wurde auch als „Isobenzol“ bezeichnet.[27] Die Allenform (vgl. Abbildung) ist vermutlich etwas stabiler als die Diradikalform.
Siehe auch
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 Eintrag zu Benzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. April 2013 (JavaScript erforderlich).
- ↑ Heinz G. O. Becker, Werner Berger und Günter Domschke: Organikum. 22. Auflage, Wiley-VCH, Weinheim 2004, ISBN 978-3-527-31148-4, S. 732.
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 71-43-2 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Gemischen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Günter Jeromin, Organische Chemie: Ein praxisbezogenes Lehrbuch, Harry Deutsch, Frankfurt a. M. 2006, ISBN 978-3-8171-1732-1, S. 215.
- ↑ Thomas Hillenbrand, Frank Marscheider-Weidemann, Manuel Strauch, Kerstin Heitmann, Dora Schaffrin: Emissionsminderung für prioritäre und prioritäre gefährliche Stoffe der Wasserrahmenrichtlinie. (PDF; 3,7 MB) Stoffdatenblätter 29-07 des Umweltbundesamts, Abschnitt 16.3 (ISSN 1862-4804).
- ↑ 7,0 7,1 James W. Weaver, Linda R. Exum, Lourdes M. Prieto: Gasoline Composition Regulations Affecting LUST Sites. (PDF; 1,1 MB) Veröffentlichung der EPA, Januar 2010, S. 18.
- ↑ E. Mitscherlich: Ueber das Benzol und die Säuren der Oel- und Talgarten, in: Annalen der Pharmacie, 1834, 9 (1), S. 39–48 (doi:10.1002/jlac.18340090103).
- ↑ Stephan Kekule von Stradonitz: Zwei chemische Visionen, in: Zeitschrift für Angewandte Chemie, 1927, 40 (25), S. 736–737 (doi:10.1002/ange.19270402505).
- ↑ Alan R. Katritzky: Advances in heterocyclic chemistry. Band 17, 1974, S. 7.
- ↑ Eric D. Glendening, Rudiger Faust, Andrew Streitwieser, K. Peter C. Vollhardt, Frank Weinhold: The role of delocalization in benzene in: Journal of the American Chemical Society, 1993, 115 (23), S. 10952–10957 (doi:10.1021/ja00076a061).
- ↑ E. Cox: Crystal Structure of Benzene, in: Reviews of Modern Physics, 1958, 30 (1), S. 159–162 (doi:10.1103/RevModPhys.30.159).
- ↑ Philippe C. Hiberty, David Danovich, Avital Shurki, Sason Shaik: Why Does Benzene Possess a D6h Symmetry? A Quasiclassical State Approach for Probing π-Bonding and Delocalization Energies, in: Journal of the American Chemical Society, 1995, 117 (29), S. 7760–7768 (doi:10.1021/ja00134a022).
- ↑ Artikel Fotografische Bestätigung der Benzol-Strukturformel auf elektronik.net, abgerufen am 13. Juni 2013.
- ↑ Artikel Atom by Atom, Bond by Bond, a Chemical Reaction Caught in the Act, Pressemitteilung des Lawrence Berkeley National Laboratory, abgerufen am 13. Juni 2013.
- ↑ Sicherheitsdatenblatt firstfuelbank (PDF; 36 kB) Stand: Februar 2003
- ↑ EPA: Summary and Analysis of the 2009 Gasoline Benzene Pre-Compliance Reports. (PDF; 389 kB) November 2009.
- ↑ Felicity Barringer: E.P.A. Limits the Benzene in Gasoline by 2011. Artikel in der New York Times vom 10. Februar 2007.
- ↑ Umweltbundesamt: Benzolbelastung der Luft in Ballungsgebieten Stand: November 2011.
- ↑ Walter Reppe, Walter Joachim Schweckendiek: Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen, in: Justus Liebigs Annalen der Chemie, 1948, 560 (1), S. 104–116 (doi:10.1002/jlac.19485600104).
- ↑ Marktstudie Benzol von Ceresana Research vom Juli 2011.
- ↑ 22,0 22,1 22,2 22,3 22,4 E. Brandes, W. Möller: Sicherheitstechnische Kenndaten – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Beyer, Walter: Lehrbuch der organischen Chemie; 22. Aufl.; S. Hirzel-Verlag, 1991.
- ↑ Thomas Hillenbrand, Frank Marscheider-Weidemann, Manuel Strauch, Kerstin Heitmann, Dora Schaffrin: Emissionsminderung für prioritäre und prioritäre gefährliche Stoffe der Wasserrahmenrichtlinie. (PDF; 3,7 MB) Stoffdatenblätter 29-07 des Umweltbundesamts, Abschnitt 18.2 (ISSN 1862-4804).
- ↑ Chemikalien-Verbotsverordnung – gesetze-im-internet.de
- ↑ G. Eisenbrand, M. Metzler: Toxikologie für Chemiker, Georg Thieme Verlag, Stuttgart 1990, ISBN 3-13-127001-2, S. 20.
- ↑ Manfred Christl und Stefan Groetsch (2000): Cyclohexa-1,2,4-triene from 1-Bromocyclohexa-1,4-diene. In: Eur. J. Org. Chem. 2000(10); 1871–1874; doi:10.1002/(SICI)1099-0690(200005)2000:10<1871::AID-EJOC1871>3.0.CO;2-3.
Literatur
- E. Heilbronner, J. Jacques: Paul Havrez und seine Benzolformel, in: Chemie in unserer Zeit, 1998, 32, S. 256–264 (doi:10.1002/ciuz.19980320505, mit Diskussion früher Benzolformeln).
- Elke Schimming: Die Belastung des Menschen durch Benzol und andere aromatische Kohlenwasserstoffe unter besonderer Berücksichtigung des Beitrages der Innenraumluft, Cuvillier Verlag, Göttingen 1998, ISBN 3-89712-195-6.
- C. J. Estler: Pharmakologie und Toxikologie, Schattauer Verlag, Stuttgart 1992/2005, ISBN 3-7945-2295-8.
Weblinks
| Dieser Artikel wurde am 30. Oktober 2010 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Benzol aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |








