| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
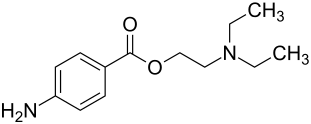
Procain
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| Allgemeines | |||||||||||||||
| Freiname | Procain | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C13H20N2O2 | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| PubChem | 4914 | ||||||||||||||
| ATC-Code | |||||||||||||||
| DrugBank | DB00721 | ||||||||||||||
| Arzneistoffangaben | |||||||||||||||
| Wirkstoffklasse | |||||||||||||||
| Wirkmechanismus |
Blockade spannungsabhängiger Natriumkanäle[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | |||||||||||||||
| Schmelzpunkt |
| ||||||||||||||
| pKs-Wert |
8,05 (15 °C)[3] | ||||||||||||||
| Löslichkeit |
Wasser: 9,45 g·l−1 (30 °C)[3] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Toxikologische Daten | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Procain ist ein Lokalanästhetikum vom Ester-Typ, das zuerst in der Zahnmedizin eingesetzt wurde. Es ist hauptsächlich unter dem Markennamen Novocain oder Novocaine bekannt.
Geschichte
Procain wurde 1904 von den deutschen Chemikern Alfred Einhorn und Uhlfelder synthetisiert und im Jahre 1905 in den Handel gebracht, welche dem Wirkstoff den Namen Novocain zuordneten (von lat. novus „neu“ und cain – abgeleitet von Cocain).[7][8]
Anwendung
Procain wird für die Lokalanästhesie nur noch selten verwendet, da hierfür wirksamere, weit tiefer eindringfähige Stoffe, wie etwa Lidocain, zur Verfügung stehen. Allerdings wird es weiterhin – wegen seiner geringen parasympatolytischen, antientzündlichen und perfusionssteigernden Wirkung – in der Neuraltherapie verwendet, einer Behandlungsform aus dem Bereich der Alternativmedizin. Procain kann das Enzym DNA-Methylase hemmen.[9] Diese Eigenschaft könnte genutzt werden, um paragenetische Schäden der Genexpression rückgängig zu machen. Dies ist vor allem bei Schäden an sogenannten Tumorsuppressorgenen wie p53 interessant.
Vor der Entdeckung des Procains war Cocain das meistverwendete Lokalanästhetikum. Procain besitzt keine euphorisierende Wirkung wie Cocain und fällt daher nicht unter den Geltungsbereich der Betäubungsmittelgesetze und -verordnungen.
Hinweis: Bei Patienten mit einem Melkersson-Rosenthal-Syndrom können allergische und toxische Reaktionen des Nervensystems auftreten!
Wirkmechanismus
Durch den Einsatz von Procain werden spannungsabhängige Natriumkanäle blockiert und somit der schnelle Natriumeinstrom (der für eine Depolarisation an der Zellmembran von Axonen zuständig ist) verhindert. Dadurch wird eine Reizweiterleitung unterbunden. In geringerem Maße werden auch andere Ionenkanäle wie z. B. Kaliumkanäle blockiert. Damit das Lokalanästhetikum am Ionenkanal wirken kann, muss es in seiner unprotonierten Form in die Zelle eindringen und dort in protonierter Wirkform am Natriumkanal angreifen. Der Einsatz in entzündlichem Gewebe ist erschwert, da dort das pH-Gleichgewicht auf die Seite der protonierten Form verschoben ist und das geladene Molekül die Zellmembran nicht penetriert.[1]
Abbau
Procain wird im Blut und in den Geweben durch die Pseudocholinesterase in Paraaminobenzoesäure (PABA) und Diethylaminoethanol verstoffwechselt.
Herstellung
Es sind zwei verschiedene Methoden zur Procain-Synthese in der Literatur beschrieben.[10] Die basenkatalysierte Umesterung von 4-Aminobenzoesäureethylester mit 2-Diethylaminoethanol liefert direkt Procain:
Alternativ kann Procain aus 4-Nitrobenzoesäure hergestellt werden. Dazu wird 4-Nitrobenzoesäure mit Thionylchlorid in 4-Nitrobenzoesäurechlorid umgewandelt. Dann wird mit 2-Diethylaminoethanol verestert und die Nitrogruppe mit Wasserstoff/Raney-Nickel zur Aminogruppe reduziert.
Einzelnachweise
- ↑ 1,0 1,1 Mutschler, Geisslinger, Kroemer, Schäfer-Korting, Mutschler Arzneimittelwirkungen, 8. Auflage, 2001, ISBN 3-8047-1763-2, S. 267 ff.
- ↑ 2,0 2,1 The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1333–1334, ISBN 978-0-911910-00-1.
- ↑ 3,0 3,1 3,2 Eintrag zu Procain in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM).
- ↑ 4,0 4,1 Datenblatt Procaine hydrochloride bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Gemischen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt PROCAINE HYDROCHLORIDE CRS (PDF) beim EDQM, abgerufen am 1. September 2008.
- ↑ Zur Geschichte des Novocains Apothekerzeitung Heft 13/14 (1950) S. 175.
- ↑ U. Glade, Die Geschichte der Anästhesie Uni Bremen
- ↑ A. Villar-Garea, M. F. Fraga, J. Espada, M. Esteller: Procaine is a DNA-demethylating agent with growth-inhibitory effects in human cancer cells. In: Cancer research. Band 63, Nummer 16, August 2003, S. 4984–4989, ISSN 0008-5472. PMID 12941824.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
Handelsnamen
Geroaslan-H3 (A), Gerovital H 3 (A), Hewedolor (D), K.H.3 (A), Lophakomp-Procain (D), Novanaest (A), Pasconeural (D), diverse Generika (D)
Gero-H3-Aslan (D), Fortepen (A), Ginvapast (CH), NeyChon (D), NeyGero (D), NeyGeront (D), Otalgan (D, CH), Otosan (CH), Retarpen compositum (A)
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Procain aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |
