| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Osteoporose
| Klassifikation nach ICD-10 | ||
|---|---|---|
| M80.- | Osteoporose mit pathologischer Fraktur | |
| M81.- | Osteoporose ohne pathologische Fraktur | |
| M82.- | Osteoporose bei anderenorts klassifizierten Krankheiten | |
| ICD-10 online (WHO-Version 2013) | ||
Die Osteoporose (von altgriechisch ὀστούν ostoun ‚Knochen‘ und πόρος poros ‚Furt, Pore‘) ist eine häufige Alterserkrankung des Knochens, die ihn für Brüche (Frakturen) anfälliger macht. Die auch als Knochenschwund bezeichnete Krankheit ist gekennzeichnet durch eine Abnahme der Knochendichte durch den übermäßig raschen Abbau der Knochensubstanz und -struktur. Die erhöhte Frakturanfälligkeit kann das ganze Skelett betreffen.
Die Osteoporose ist die häufigste Knochenerkrankung im höheren Lebensalter. Am häufigsten (95 Prozent) ist die primäre Osteoporose, das heißt diejenige Osteoporose, die im Gegensatz zur sekundären Osteoporose nicht als Folge einer anderen Erkrankung auftritt. 80 Prozent aller Osteoporosen betreffen postmenopausale Frauen. 30 % aller Frauen entwickeln nach der Menopause eine klinisch relevante Osteoporose. Sekundäre Osteoporosen sind seltener (5 %), wobei Erkrankungen, die eine Behandlung mit Glukokortikoiden während einer längeren Zeitspanne erfordern und/oder zu einer Immobilisation führen, im Vordergrund stehen.
Häufige Folgen der Osteoporose sind Knochenbrüche. Nach Häufigkeit sortiert sind dies:
- Wirbelkörper-Einbrüche (Sinterungen, Kompressionsfrakturen)
- Hüftgelenksnahe Oberschenkelknochenbrüche (u. a. Schenkelhalsfraktur)
- Handgelenksnahe Speichenbrüche (distale Radiusfraktur)
- Oberarmkopfbruch (subcapitale Humerusfraktur)
- Beckenbruch
Außerdem besteht eine vermehrte Anfälligkeit für Frakturen an anderen Stellen des Skeletts.
Ursachen
Die Knochenmasse nimmt etwa in den ersten drei Lebensjahrzehnten zu (in der Jugend wird Knochen aufgebaut), erreicht dann einen Höhepunkt und fällt in den späteren Lebensjahren langsam wieder ab. Die Osteoporose entsteht meist aus einer unzureichenden Knochenbildung in jungen Jahren und/oder einem beschleunigten Abbau in späterer Zeit. Ursachen dafür können sein:
- Primäre Osteoporose (95 %):
- Idiopathische juvenile Osteoporose junger Menschen
- Postmenopausale Osteoporose (Typ-I-Osteoporose)
- Senile Osteoporose (Typ-II-Osteoporose)
- Sekundäre Osteoporose (5 %):
- Hormonell: Hyperkortisolismus (Cushing-Syndrom), Hypogonadismus, Hyperparathyreoidismus, Hyperthyreose
- Gastroenterologische Ursachen: Malnutrition, Anorexia nervosa (Magersucht), Malabsorption, renale Osteopathie
- Immobilisation (eingeschränkte Bewegung)
- Medikamentös:[1]
- Langzeittherapie mit Kortikosteroiden (Cortisol), wirkt wie ein Cushing-Syndrom
- Langzeittherapie mit Heparin (zur Hemmung der Blutgerinnung)
- Vitamin-K-Antagonisten als Antikoagulanzien wie Marcoumar vermindern die Knochendichte, da Vitamin K für die Reifung der Knochenmatrix notwendig ist. Hingegen gibt es keinen Hinweis, dass die Einnahme von Vitamin K einen Effekt auf die Knochendichte oder das Frakturrisiko hat.[2]
- Magensäure blockierende Medikamente[3]
- Hochdosierte Therapie mit Schilddrüsenhormonen vermindert die Knochendichte ebenso wie eine Hyperthyreose.
- Gonadotropin-Releasing-Hormon-Antagonisten bei Einnahme von über einem Jahr Dauer, hemmen fast vollständig die Östrogenbildung in den Ovarien
- Aromatasehemmer hemmen ebenfalls die Östrogenbildung.
- Zytostatika
- Laxanzienabusus und Langzeittherapie mit Cholestyramin reduzieren die Resorption von Vitamin D im Verdauungstrakt.
- Lithium kann zu erhöhten Parathormonspiegeln führen und damit eine Osteoporose auslösen.
- Hereditär:
- Neoplastische Erkrankungen:
- Multiples Myelom
- Mastozytose
- Myeloproliferative Erkrankungen
- Entzündungen:
- Chronische Polyarthritis
- Morbus Crohn
- Colitis ulcerosa
- Andere Ursachen:
- Perniziöse Anämie, Vitamin-B12-Mangel
- Folsäuremangel[4]
- Untergewicht
- Fleischreiche, gemüse-/obstarme Ernährung scheint ungünstig zu sein. Es wurde unter anderem ein Zusammenhang des Knochenstoffwechsels mit dem Säure-Basen-Haushalt vermutet, der sich jedoch nicht bewahrheitet hat.[5]
- Konsum von phosphathaltigen Colagetränken könnte ein Risiko darstellen, allerdings korreliert starker Colakonsum mit einer kalziumarmen Ernährung[6]
Antikonvulsiva hingegen bewirken eine Osteomalazie, keine Osteoporose.
Diagnostik
Anamnese
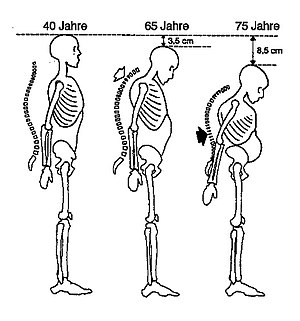
Angabe von Rückenschmerzen als Leitsymptom osteoporotischer Wirbelkörperfrakturen, Verminderung der Körpergröße durch Sinterung von Wirbelkörpern und Kyphose/Skoliose der Wirbelsäule, Frakturen von Oberschenkelhals und distalem Radius. Erfassung der o. g. Risikofaktoren für Osteoporose, insbesondere calciumarme Ernährung, frühe Menopause und familiäre Belastung, Hinweise auf andere systemische Knochenerkrankungen.
Klinische Untersuchung
Messung der Körpergröße (Vergleich zu früheren Ergebnissen oder Angaben), Kyphose der Brustwirbelsäule / Skoliose der Lendenwirbelsäule, typische Hautfalten am Rücken („Tannenbaum-Phänomen“), Verringerung des Abstands von Rippenbogen und Beckenkamm.
Röntgen
Untersuchung von Brust- und Lendenwirbelsäule zur Aufdeckung von Frakturen und Höhenminderungen.
Biomarker
Die erhöhte Ausscheidung von C-Telopeptiden des Typ I [Kollagen] über den Urin kann für die Diagnose von Osteoporose und Osteoarthritis herangezogen werden. Sowie für die Einschätzung des momentanen Krankheitsverlaufs.[7][8]
Knochendichtemessung
(Osteodensitometrie), bei der der T-Wert ermittelt wird. Dies ist ein statistischer Wert, der einen Vergleich des gemessenen Knochendichtewertes mit der Population junger erwachsener Frauen und eine Aussage zum Bruchrisiko ermöglicht. Zur Messung der Knochendichte (BMD – engl. für bone mineral density) stehen verschiedene Techniken zur Verfügung:
Am weitesten verbreitet ist die Dual-Röntgen-Absorptiometrie (DXA oder DEXA – engl. dual-energy-x-ray-absorptiometry). Auf ihr basiert auch die Definition der WHO und mit ihrer Hilfe wird der T-Wert ermittelt. Eine weitere Methode stellt die quantitative Computertomographie (QCT bzw. pQCT) dar. Die Messung der Knochendichte mittels Ultraschalls, also mit dem sogenannten quantitativen Ultraschall (QUS), ist höchst umstritten und nur in ganz wenigen Fällen überhaupt aussagekräftig. Die Aussagekraft für DXA und QCT ist hingegen gut belegt. Die Messung der Knochendichte zur Früherkennung ist keine Leistung der gesetzlichen Kassen. Der Versicherte muss sie selbst bezahlen, wenn vor der Messung kein Knochenbruch ohne entsprechende Krafteinwirkung (ein sogenannter Ermüdungsbruch) mit Verdacht auf Osteoporose vorliegt.
Die Knochendichte selbst ist jedoch nur zum Teil für das erhöhte Bruchrisiko der Knochen bei Osteoporose verantwortlich; die Bruchfestigkeit wird im Wesentlichen von der äußeren Compacta-Schicht bestimmt, während die Knochendichtemessung vor allem auch den trabekulären Knochen misst.[9]
Ausgehend von einer Knochendichtemessung kann über den computerbasierten Algorithmus FRAX (WHO Fracture Risk Assessment Tool) die Wahrscheinlichkeit bestimmt werden, in den folgenden zehn Jahren eine osteoporotische Fraktur zu erleiden. Dies ist besonders für die Abschätzung der Notwendigkeit einer antiresorptiven Therapie bei einer Osteopenie geeignet.[10]
Zu beachten sind besonders beim älteren Menschen häufige Fehlerquellen bei der DXA-Messung an der Lendenwirbelsäule mit Verschleierung einer verminderten oder sogar Vortäuschung einer höheren Knochendichte: durch Sinterung von Wirbelkörpern, Skoliose, Spondylophyten oder Arterienverkalkung (Aortosklerose). Für ein verwertbares Ergebnis müssen wenigstens zwei Wirbelkörper beurteilbar sein.[11]
Wenn bereits osteoporotische Frakturen im Röntgenbild nachgewiesen wurden oder eine pertrochantäre Femurfraktur aufgetreten ist, kann auch ohne vorherige DXA-Messung die Diagnose einer Osteoporose gestellt und eine adäquate Therapie eingeleitet werden.[12]
Krankheitsverlauf und Prognose
Die Osteoporose ist eine zunächst unmerklich verlaufende Erkrankung, die aber im Fall von Knochenbrüchen, insbesondere bei alten Menschen, eine hohe Krankheitsbelastung (Schmerzen, Bettlägerigkeit, manchmal dauerhafte Immobilisierung) bedeutet.
Man unterscheidet zwischen primärer und sekundärer Osteoporose. Zur wesentlich häufigeren primären Osteoporose zählen die postmenopausale (oder postklimakterische) Osteoporose und die Altersosteoporose (Involutionsosteoporose). Die sekundäre Osteoporose tritt unter anderem als Folge von Stoffwechselerkrankungen oder hormonellen Störungen auf.
Man geht davon aus, dass in Deutschland etwa 30 % aller Frauen nach dem Klimakterium an primärer Osteoporose erkranken. Für Männer ist ab dem 70. Lebensjahr die Altersosteoporose ein ebenso häufiges Krankheitsbild. Typische Merkmale der Osteoporose sind eine Abnahme der Knochenmasse und Verschlechterung der Knochenarchitektur sowie als deren Folge eine Abnahme der Knochenstabilität. Dies führt zu einer erhöhten Gefahr von Knochendeformationen (Fischwirbel) und Knochenbrüchen. Knochenbrüche bei Osteoporose finden sich insbesondere an den Wirbeln, am Oberschenkelhals und am Handgelenk. Die Heilung von Knochenbrüchen bei Osteoporose ist nicht gestört, der Zeitrahmen ist der gleiche wie bei nicht erkrankten Menschen. Die Folgen der Brüche können jedoch vor allem bei Älteren nachhaltig sein und durch Folgeerkrankungen wie Lungenentzündung oder Lungenembolie zum Tode führen.
Behandlungsmöglichkeiten und Prävention
Lebensweise
Körperliche Aktivität schützt vor Knochenschwund. Die Kräfte, die dabei auf den Knochen wirken, regen die knochenaufbauenden Zellen an, neue Knochensubstanz zu bilden. Daneben fördert ausreichendes Sonnenlicht, empfohlen wird eine halbe Stunde täglich,[13] die Vitamin-D-Produktion der Haut.
Ernährung
Zur Prävention trägt eine ausreichende Calcium-Aufnahme von etwa 1 g/Tag entscheidend bei (Basistherapie DVO). Ein Gramm Calcium ist in einem Liter Milch oder 100 g Hartkäse enthalten. Neben Milchprodukten (hierbei vor allem Milch und Joghurt[14]) sind vor allem grüne Gemüsesorten wie Grünkohl und Broccoli sehr gute Calcium-Lieferanten. Wer keine Milch trinkt und keinen Käse isst, sollte täglich 800 mg Calcium in Tablettenform zu sich nehmen.
Als Bestandteil der Basistherapie empfehlen die internationalen Leitlinien ferner die Einnahme von Vitamin D (Ergo- und Cholecalciferol, nicht aber Metabolite wie 1-alpha- oder 1,25-Dihydroxy-Vitamin D).
Starker Alkohol- und Tabakkonsum soll vermieden werden.[13][15][16]
Obwohl Vitamin K bei der Reifung der Knochenmatrix benötigt wird und bei langfristiger Einnahme von Vitamin-K-Antagonisten wie Marcumar das Osteoporoserisiko steigt, gibt es keinen Hinweis darauf, dass die Einnahme von Vitamin K einen positiven Effekt hat. Diesbezüglich existiert auch keine qualitative Studie. Während in sämtlichen evidenzbasierten Richtlinien die Einnahme von Vitamin D und Kalzium empfohlen wird, gibt es keine Empfehlung zur Vitamin-K-Einnahme.[17]
Pharmakotherapie
Nach den Leitlinien des DVO wird, unter Berücksichtigung der Knochendichte, des Lebensalters, stattgehabter Wirbelkörperfrakturen und anderer Risikofaktoren, folgende medikamentöse Therapie empfohlen:
- Bisphosphonate (Alendronsäure, Ibandronsäure, Risedronat und Zoledronat): Standard-Therapie, hemmen die Knochenresorption
- Selektive Östrogen-Rezeptor-Modulatoren (SERM): Raloxifen (nur zur Verhinderung von Wirbelkörperfrakturen). Hemmen ebenfalls die Knochenresorption
oder
- Parathormon und sein Analogon Teriparatid
- Strontiumranelat: Knochendichtemessungen zeigen durch die Einlagerung von Strontium höhere Werte, was aber für die Verlaufsbeurteilung in der Praxis nicht relevant ist.
Zur Überwachung der antiresorptiven Osteoporose-Therapie kann der Knochenmarker β-CrossLaps eingesetzt werden. Auch in Verwendung, jedoch nicht vom DVO empfohlen sind
- Calcitonin, kaum noch verwendet, der Nutzen ist schlecht belegt. Außerdem kommt es meistens zu schweren Allergiesymptomen bei der Behandlung.
- STH (Wachstumshormon), kein Nutzen belegt; evtl. problematische Nebenwirkungen.
- Fluoride (veraltet; entwickeln harte, aber spröde Knochen, die Stabilität wird nicht besser)
- Östrogene werden seit der Kritik an der Hormonersatztherapie wegen Nebenwirkungen nur eingeschränkt für diese Indikation verwendet, sind aber zweifelsfrei bei der postmenopausalen Frau hinsichtlich der Osteoporose-Prävention und Behandlung gut wirksam. Die Entscheidung Pro oder Contra muss individuell getroffen werden.
- Vitamin-D-Metabolite wie 1-alpha- oder 1,25-Dihydroxy-Vitamin D (Nutzen bei postmenopausaler Osteoporose nicht eindeutig belegt, teuer, problematische Nebenwirkungen; 1,25-Vitamin D (Calcitriol) ist wirksam und indiziert bei bestimmten Knochenerkrankungen im Rahmen fortgeschrittener Nierenerkrankungen).
Eine neue Osteoporose-Behandlungsmöglichkeit stellt Denosumab dar. Dabei handelt es sich um einen monoklonalen Antikörper, der einmal halbjährlich als Spritze unter die Haut verabreicht wird. Am 28. Mai 2010 wurde Denosumab (mit dem Handelsnamen Prolia) für alle 27 Mitgliedsstaaten der Europäischen Union (EU) sowie in Norwegen, Island und Liechtenstein zur Behandlung der Osteoporose bei postmenopausalen Frauen mit erhöhtem Frakturrisiko und zur Behandlung eines Knochendichteverlustes durch eine hormonablative Therapie (Androgendeprivation) bei Männern mit Prostatakarzinom und erhöhtem Frakturrisiko zugelassen.[18][19]
Die tägliche Anwendung einer nitroglycerinhaltigen Salbe erhöhte in einer Studie kanadischer Forscher die Knochendichte deutlich. Ob dadurch das Risiko von Knochenbrüchen verringert wird, wird jedoch nicht belegt. Die Wirkung wird mit der Freisetzung von Stickoxid erklärt, welches die Osteoklasten direkt hemmt.[20]
Dass eine Erhöhung der Knochendichte nicht mit einem verminderten Knochenbruchrisiko einhergehen muss, sondern es sogar erhöhen kann, zeigt das Beispiel der Fluoride, die das Bruchrisiko erhöhen können (Fluorose). Daher ist es unerlässlich, für neue Osteoporose-Mittel Studien durchzuführen, die eine Verminderung des Bruchrisikos nachweisen und die dabei auch den bereits bekannten Mitteln in ihrer Wirksamkeit nicht unterlegen sein dürfen.
Verhinderung von Brüchen
Eine effektive Methode, osteoporotischen Oberschenkelhalsfrakturen vorzubeugen, ist der Einsatz von Hüftprotektoren.
Alternativmedizin
Zur Vorbeugung bzw. Behandlung von Osteoporose gibt es auch verschiedene Verfahren der alternativen Medizin, die jedoch keine Wirksamkeitsnachweise nach wissenschaftlichen Kriterien erbringen konnten. Die Behandlungskosten dieser Verfahren werden entsprechend auch kaum von Krankenkassen getragen.
Basische Ernährung
Basische Ernährung oder die Einnahme von Basensalzmischungen. Eine Übersäuerung des Körpers soll nach Angaben von Anhängern dieser Behandlungsmethode zu verstärktem Knochenschwund führen, da Calciumsalze als Puffersubstanzen Verwendung fänden.[21] Bei dieser Theorie werden allerdings die weitaus bedeutenderen Puffersysteme der Blutpuffer vernachlässigt. Es werden der Verzicht auf Bohnenkaffee, Schwarztee, Alkohol, Cola- und Limonadengetränke, tierisches Eiweiß (Fleisch, Wurst, Fisch), Fast Food und Fertiggerichte, die meisten Milchprodukte, Industriezucker, Süßstoffe, Süßigkeiten, Weißmehl und Weißmehlprodukte, Erdnüsse, Paranüsse usw. empfohlen und eine säurehemmende oder basenbildende Nahrung verordnet, bestehend etwa aus Gemüse- und Fruchtsäften, Kräutertee, Gemüse und Blattsalaten sowie Früchten. Die Regeln, nach denen ein Lebensmittel in säurebildend oder basisch einzuteilen ist, sind dabei nicht immer direkt nachvollziehbar, so wirkt beispielsweise Kaffee im Blut nicht etwa säurebildend, sondern schwach basisch.
Eine basenreiche Kost sei demnach besonders förderlich für einen gesunden Knochenstoffwechsel: Zahlreiche Untersuchungen zeigen, dass sich der höhere Basengehalt in pflanzlicher Nahrung positiv auf die Knochendichte auswirke. Um diese Aussage zu stützen, berufen sich die Vertreter der basischen Medizin auf Studien wie folgende, in denen gezeigt wurde, dass eine protein- und fleischreiche Kost den Calciumabbau aus den Knochen und die Calciumausscheidung über die Nieren fördere.[22][23][24] In diesen Studien wird allerdings mit keinem Wort von einer säure- oder basenbildenden Kost gesprochen.
Eine weitere Aussage der basischen Ernährungslehre ist, dass eine säurereiche Kost nicht nur im kranken, sondern auch im gesunden Organismus zu einer systematischen Übersäuerung führe, die im Alter mit abnehmender Nierenfunktion zunimmt. [25] Diese postulierte Übersäuerung ist allerdings im Blut im Rahmen einer Blutgasanalyse nicht messbar. Eine Übersäuerung des Urins ist primär nur ein Zeichen dafür, dass die Blutpuffer und die Niere ihren Aufgaben nachkommen und Säuren ausscheiden.
Bei zunehmender Übersäuerung erschöpfen sich die Pufferreserven des Körpers, und Mineralstoffdepots in den Knochen würden verstärkt angegriffen. Zudem setze der Körper in einem sauren Milieu vermehrt entzündungsfördernde Proteine wie NF-κB, TNF-α und COX-2 frei, die den Knochenabbau beschleunigen.[26][27] Diese Übersäuerungen finden sich allerdings nicht in einem gesunden Organismus bei regulärer Nahrungsaufnahme, sondern bei einer deutlichen Einschränkung der Funktion der Blutpuffer und der Ausscheidungsfunktion der Niere.
Um dem Verlust von Knochensubstanz entgegenzuwirken, werden sogenannte basische Substanzen wie Kaliumcitrat empfohlen. Für Kaliumcitrat sei in klinischen Studien nachgewiesen, dass es dem Calciumverlust über die Niere und dem Calciumabbau aus den Knochen entgegenwirkt.[28][29][30] So zeigte eine prospektive kontrollierte Interventionsstudie bei 161 postmenopausalen Frauen mit Osteopenie, dass die partielle Neutralisierung einer diätinduzierten Säurebelastung (mittels 30 mmol Kaliumcitrat pro Tag, entspricht 1,173 g Kalium) über einen Zeitraum von zwölf Monaten die Knochendichte signifikant erhöhe und die Knochenstruktur deutlich verbessere. Kaliumcitrat wirke dabei genauso effektiv wie Raloxifen, ein Östrogen-Rezeptor-Modulator, der bei der Behandlung und Prävention von Osteoporose bei postmenopausalen Frauen eingesetzt wird.[28] Durch den Ausgleich des Säure-Basen-Haushalts würde also die ungünstige Calciumüberladung des Blutes verhindert, weil das Calcium im Knochen bleibt und nicht als Puffersubstanz entnommen wird. Dabei sei es sinnvoll, das Kaliumcitrat mit den Knochenmineralien Calcium und Magnesium sowie Vitamin D zuzuführen, weil laut basischer Lehre sich der Magnesiumgehalt im Knochen genauso stark vermindere wie der des Calciums.
Weitere Alternativmedizinische Verfahren
- Magnetfeldtherapie: pulsierende elektromagnetische Felder sollen den Knochenaufbau stimulieren.
- Vibrationstraining – auch biomechanische Stimulation (BMS): sie wurde ursprünglich zur Behandlung von russischen Kosmonauten entwickelt: Die zu behandelnde Person steht auf einer Platte, die in einem Frequenzbereich von 20 bis etwa 50 Hz vibriert und durch den Dehnreflex Muskelkontraktionen hervorruft. Die dabei auftretenden Kräfte sollen den Knochen zum Wachstum stimulieren (Mechanostat), erste einzelne wissenschaftliche Untersuchungen hierzu liegen vor.[31]
Wirtschaftliche Aspekte
Mit jährlich etwa 2,5 bis 3 Milliarden Euro an direkten und indirekten Krankheitskosten in Deutschland hat die Osteoporose auch ein großes volkswirtschaftliches Gewicht. Deshalb wurde sie von der Weltgesundheitsorganisation (WHO) auf die Liste der zehn wichtigsten Erkrankungen gesetzt.
Von Kritikern wird angeführt, dass die Neubewertung der Osteoporose in den 1990er Jahren durch die Pharmaindustrie und die Hersteller von Diagnostika gesteuert sei, die einen Absatzmarkt für neue diagnostische Geräte und Medikamente schaffen wollen (Disease Mongering)[32][33]. Andererseits lässt sich erst seit etwa 1985 die Knochendichte zuverlässig messen. Erst seitdem ist es überhaupt möglich, das Krankheitsbild schon vor dem Auftreten von Knochenbrüchen adäquat zu erfassen, präventiv zu behandeln und Frakturen zu verhindern.
Siehe auch
- Expertenstandard Sturzprophylaxe in der professionellen Pflege
- Weltosteoporosetag
Literatur
- Walter Siegenthaler, Hurbert E. Blum: Klinische Pathophysiologie. 9. völlig neu bearbeitete Auflage. Georg Thieme Verlag, Stuttgart u. a. 2006, ISBN 3-13-449609-7.
- Österreichische Ärztekammer (Hrsg.): Faltblatt Osteoporose-Information, Wien 2007.
- Beat Seiler: Gesundheitspolitisches Programm für eine angemessene Osteoporose-Versorgung. Verlag Schweizerische Gesellschaft für Gesundheitspolitik SGGP, Zürich 2006, ISBN 3-85707-85-4 (formal falsche ISBN), (Schriftenreihe der SGGP 85).
Weblinks
Organisationen
- Wissenschaftlicher Dachverband Osteologie (DVO) / S3-Leitlinie für Osteoporose
- www.osteoporose.org – Kuratorium Knochengesundheit
- www.netzwerk-osteoporose.de (NWO)– Netzwerk-Osteoporose – gemeinnützige Organisation für Patientenkompetenz e.V. zur bundesweiten Förderung von Selbsthilfe, Rehabilitationssport, Funktionstraining und der Organisationsstrukturen in der Osteoporoseselbsthilfe.
- International Osteoporosis Foundation
- Deutsche Rheuma-Liga
Informationen
- Patientenleitlinie 2010 des Dachverband deutschsprachiger Osteoporose Selbsthilfeverbände und patientenorientierter Osteoporose Organisationen e.V. (DOP) Schweiz, Österreich und Deutschland (PDF 1 MB)
- Patientenleitlinie (2009) des Dachverbands Osteologie (DVO)
- Erika Baum, Klaus M. Peters: Primäre Osteoporose – leitliniengerechte Diagnostik und Therapie. In: Dtsch Arztebl. Nr. 105(33), 2008, S. 573–582 (Übersichtsarbeit).
Einzelnachweise
- ↑ M. J. Seibel, H. Stracke: Metabolische Osteopathien. Schattauer-Verlag, Stuttgart 1997, (ISBN 3-7945-1635-4)
- ↑ Y. Sato et al.: Long-term Oral Anticoagulation Reduces Bone Mass in Patients with Previous Hemispheric Infarction and Nonrheumatic Atrial Fibrillation. Stroke 1997; 28: 2390–2394
- ↑ Mangel an Magensäure beeinflusst Kalzium-Aufnahme
- ↑ Uniklinikum Saarland: Forschungsgruppe Klinische Chemie und Laboratoriumsmedizin
- ↑ A. Prentice: Diet, nutrition and the prevention of osteoporosis. In: Public Health Nutrition 2004 (7), S. 227–243
- ↑ KL Tucker et al.: Framingham Osteoporosis Study: Colas, but not other carbonated beverages, are associated with low bone mineral density in older women. In: American Journal of Clinical Nutrition 2006 (84), S. 936-942
- ↑ Pierre Meunier: Osteoporosis: Diagnosis and Management. London: Taylor and Francis 1998, ISBN 1-85317-412-2
- ↑ M. Skarpellini et Al, Biomarkers, type II collagen, glucosamine and chondroitin sulfate in osteoarthritis follow-up: the “Magenta osteoarthritis study", 2008, Journal of orthopaedics and traumatology official journal of the Italian Society of Orthopaedics and Traumatology S 81-87
- ↑ G. Holzer et al.: Hip fractures and the contribution of cortical versus trabecular bone to femoral neck strength. J Bone Miner Res. 2009 Mar;24(3):468-74. doi:10.1359/jbmr.081108
- ↑ A. Unnanuntana, B. P. Gladnick, E. Donnelly, J. M. Lane: The assessment of fracture risk. In: J Bone Joint Surg Am. 2010; 92-A: 743–753
- ↑ Walter Behringer, Joachim Zeeh: Diagnostik und Therapie der Osteoporose. In: Ärzteblatt Thüringen 23 (2012), S. 275–276
- ↑ Walter Behringer, Joachim Zeeh: Diagnostik und Therapie der Osteoporose. In: Ärzteblatt Thüringen 23 (2012), S. 276
- ↑ 13,0 13,1 S3-Leitlinie Prophylaxe, Diagnostik und Therapie der Osteoporose bei Erwachsenen der Empfehlungen des Dachverbandes Osteologie (DVO). In: AWMF online (Stand Oktober 2009)
- ↑ S Sahni, KL Tucker, DP Kiel, L Quach, VA Casey, MT Hannan. Milk and yogurt consumption are linked with higher bone mineral density but not with hip fracture: the Framingham Offspring Study. Archives of Osteoporosis February 2013, 8:119
- ↑ Scottish Intercollegiate Guideline Nr. 71, 2003
- ↑ Guideline der National Osteoporosis Foundation (USA), 2003
- ↑ C. J. Rosen: Postmenopausal osteoporosis. In: New England Journal of Medicine 2005; 353: 595-603
- ↑ Prolia (Denosumab) Granted Marketing Authorization in the European Union Pressemitteilung vom 28. Mai 2010
- ↑ www.prolia.de WebSite für die Fachkreise
- ↑ Effect of Nitroglycerin Ointment on Bone Density and Strength in Postmenopausal Women: A Randomized Trial. In: Journal of the American Medical Association, 2011, 305(8), S. 800–807
- ↑ W Bayer, Wolfgang Gerz: Säure-Basen-Haushalt und Osteoporose. In: Erfahrungsheilkunde 2006 (55): 142-145
- ↑ T. Arnett: Regulation of bone cell function by acid-base balance. In: Proc Nutr Soc (2003) 62: 511-520. PMID 14506899
- ↑ R. Jajoo et al.: Dietary acid-base balance, bone resorption, and calcium excretion. In: J Am Coll Nutr. (2006) 25: 224–30. PMID 16766781
- ↑ SA. New: Intake of fruit and vegetables: implications for bone health. In: Proc Nutr Soc (2003) 62: 889–899. PMID 15018489
- ↑ LA Frassetto et al.: Effect of age on blood acid-base composition in adult humans: role of age-related renal functional decline. In: Am J Physiol (1996) 271, S. 1114-1122. PMID 8997384
- ↑ KK Frick et al.: RANK ligand and TNF-alpha mediate acid-induced bone calcium efflux in vitro. In: Am J Physiol Renal Physiol (2005) 289: S. 1005-1011. PMID 15972386
- ↑ NS Krieger et al.: Regulation of COX-2 mediates acid-induced bone calcium efflux in vitro. In: J Bone Miner Res. (2007) 22, S. 907-917. PMID 15972386
- ↑ 28,0 28,1 S. Jehle et al.: Partial neutralization of the acidogenic western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. In: J Am Soc Nephrol (2006) 17: 3213–3222. PMID 17035614
- ↑ M. Marangella et al.: Effects of potassium citrate supplementation on bone metabolism. In: Calcif Tissue Int (2004) 74: 330-5. PMID 15255069
- ↑ DE Sellmeyer et al.: Potassium citrate prevents increased urine calcium excretion and bone resorption induced by a high sodium chloride diet. In: J Clin Endocrinol Metab (2002) 87: 2008-12. PMID 11994333
- ↑ Relevante Studien zum Vibrationstraining bei Osteoporose
- ↑ System ohne Steuerung. Der Spiegel, 1. November 1999. (Abgerufen 20. Januar 2014)
- ↑ Die Abschaffung der Gesundheit Der Spiegel, 11. Auust 2003. (Abgerufen 20. Januar 2014)
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Osteoporose aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |