| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Aktionspotential
Aktionspotential oder elektrische Erregung ist eine vorübergehende charakteristische Abweichung des Membranpotentials einer Zelle von ihrem Ruhepotential.
Zum Verlauf eines typischen Aktionspotentials (ugs. Nervenimpuls) gehören elektrische Auslösbarkeit mit Schwellenpotential, Refraktärzeit, Nachhyperpolarisation und Fortleitung. Der molekulare Mechanismus eines Aktionspotentials besteht in der Wechselwirkung spannungsempfindlicher Ionenkanäle. Besonders gut sind Aktionspotentiale im Axon von Nervenzellen untersucht. Dort bewirken sie die schnelle Erregungsleitung auch über weite Strecken. Diese Aktionspotentiale sind Hauptgegenstand dieses Artikels. Ähnliche Aktionspotentiale bewirken die Muskelkontraktion.
Aktionspotentiale kommen auch in Einzellern (Pantoffeltierchen[1] und Kieselalgen[2]) vor, sowie in mehrzelligen Algen (Armleuchteralgen[3]), Gefäßpflanzen (Mimose[4]) und Pilzen.[5]
Geschichte
Die Rolle von Elektrizität im Nervensystem wurde von Luigi Galvani zwischen 1791 und 1797 anhand sezierter Frösche untersucht.[6] Seine Erkenntnisse brachten Alessandro Volta dazu, die Voltasche Säule zu erfinden – die erste Batterie, welche elektrische Energie speichert. Alessandro Volta nutzte diese Batterie um mit tierischer Elektrizität (wie z. B. Elektrizität von Zitteraalen), sowie die Auswirkung von Gleichspannung auf Lebewesen zu untersuchen.[7]
1952 legten Alan Lloyd Hodgkin und Andrew Fielding Huxley ein mathematisches Modell[8] vor, das die Entstehung des Aktionspotentials im Riesenaxon des Tintenfisches durch das Wechselspiel verschiedener Ionenkanäle erklärt und unter dem Namen Hodgkin-Huxley-Modell berühmt wurde. Für diese Entdeckung erhielten die beiden Forscher zusammen mit John Eccles 1963 den Nobelpreis für Medizin.
Grundlagen
Ein Aktionspotential kann von etwa einer Millisekunde bis zu einigen Minuten dauern. Es gibt keine starken oder schwachen Aktionspotenziale, vielmehr sind es Alles-oder-Nichts-Reaktionen. Sie entstehen typischerweise am Axonhügel einer Nervenzelle und wandern das Axon entlang. Die Signalstärke wird in der Frequenz von Aktionspotenzialen wiedergegeben. Aktionspotentiale breiten sich auch rückwärts über den Zellkörper und die Dendriten aus. Die Funktion dieser Weiterleitung wird noch untersucht. Axonale Ausbreitung vom Zellkörper zum Endknöpfchen wird auch orthodrom (richtig) genannt und die gegenläufige Weiterleitung antidrom.[9]
Die Ursachen für die Ausbildung und die besonderen Eigenschaften eines Aktionspotentials liegen in den Eigenschaften verschiedener Gruppen von Ionenkanälen in der Plasmamembran der Zelle. Ein anfänglicher Reiz aktiviert, sobald er eine bestimmte Schwelle erreicht (ca. −50 mV; sog. Schwellenpotential), und ohne Rücksicht darauf, wie weit er sie übersteigt, eine Kette von Öffnungs- und Schließungsvorgängen der Kanäle, die einen Ionenstrom ermöglichen und damit das Membranpotential verändern. Die Form des Aktionspotentials ist dann, unabhängig von der Stärke des auslösenden überschwelligen Reizes, immer gleichförmig. Diese Änderung des Potentials kann an der nächsten Stelle der Membran wieder eine elektrische Erregung bewirken, was die Grundlage der Erregungsleitung ist.
Potentialverlauf
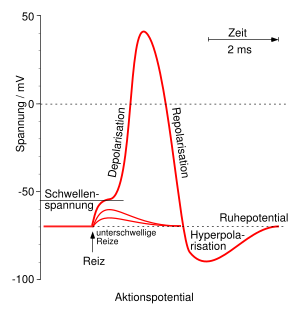
Ausgehend vom Ruhemembranpotential, das bei Neuronen je nach Zelltyp zwischen −90 und −70 mV liegt, werden vier Phasen des Aktionspotentials unterschieden:
- In der Initiationsphase treibt ein Reiz die negative Spannung in Richtung null (Depolarisation). Dies kann langsam oder schnell geschehen und ist unterhalb des Schwellenpotentials umkehrbar. Solch ein Reiz kann ein sich räumlich näherndes Aktionspotential sein oder ein postsynaptischer Ionenstrom.[10]
- Falls das Schwellenpotenzial überschritten wird, beschleunigt sich die Depolarisation stark (Aufstrich). Das Membranpotenzial wird sogar positiv (Overshoot).
- Auf das Maximum bei +20 bis +30 mV folgt die Rückkehr in Richtung Ruhepotential (Repolarisation).
- In vielen Neuronen wird das Ruhepotenzial zunächst unterschritten, bis z.B. −90 mV, und schließlich von negativeren Werten her erreicht. Dies wird als Hyperpolarisation oder hyperpolarisierendes Nachpotential bezeichnet. Während der Hyperpolarisation kann noch kein weiteres Aktionspotential ausgelöst werden, woraus sich die Maximalfrequenz von Aktionspotentialfeuer ergibt (der Begriff Feuern wird auch in wissenschaftlicher Literatur für das Generieren von Aktionspotentialen benutzt).
Ein Aktionspotential dauert etwa 1–2 ms in Neuronen, kann sich aber auch über einige hundert Millisekunden (im Herzen) erstrecken.
Bereits während der Repolarisation befindet sich die Zelle in der Refraktärphase. Während dieser Phase kann zunächst kein (absolute Refraktärzeit, ca. 0,5 ms) und danach nur mit erhöhtem Reiz (erhöhtes Schwellenpotential innerhalb der relativen Refraktärzeit, ca. 3,5 ms) ein weiteres Aktionspotential erzeugt werden.
Ursachen
Die Erklärung setzt das Verständnis der im Artikel zum Ruhemembranpotential vorgestellten Entstehung eines Ruhemembranpotentials voraus. Kurz zusammengefasst sind folgende Faktoren für das Ruhemembranpotential verantwortlich:
- chemische- und elektrische Gradienten von Ionen
- Selektive Permeabilität von Ionenkanälen
- Ionenpumpen – insbesondere Natrium-Kalium-Pumpen.
Eigenschaften der Ionenkanäle
Wie im Artikel über das Ruhemembranpotential beschrieben, verfügen Zellen über eine Reihe von Ionenkanälen. Für das tierische Aktionspotential sind vor allem bestimmte für Natrium- bzw. Kalium-Ionen spezifische Ionenkanäle verantwortlich. Diese Kanäle öffnen sich in Abhängigkeit vom Membranpotential, d. h. sie sind spannungsaktiviert. In Ruhe ist das Membranpotential negativ.
So ist beispielsweise ein spannungsabhängiger Natriumkanal (Nav-Kanal) (aufgrund seiner Eigenschaft auch als schneller Natriumkanal bezeichnet) beim Ruhemembranpotential geschlossen und aktivierbar. Bei Depolarisation über einen kanalspezifischen Wert erfolgt eine Konformationsänderung. Der Kanal wird dadurch durchlässig für Ionen und geht in den Zustand offen über. Der Kanal bleibt aber trotz anhaltender Depolarisation nicht offen, sondern wird innerhalb weniger Millisekunden unabhängig vom Membranpotential wieder geschlossen. Das geschieht meist durch einen im Zytoplasma liegenden Teil des Kanalproteins, die Inaktivierungsdomäne, die sich gleich einem „Stöpsel“ in den Kanal setzt und diesen verstopft. Diesen Zustand bezeichnet man als geschlossen und inaktiviert. Der Übergang in den Zustand geschlossen und aktivierbar ist nur nach einer Hyperpolarisation (oder vollständiger Repolarisation bei Herzmuskelzellen) möglich, der Übergang vom Zustand geschlossen und inaktiviert zum Zustand offen ist im vereinfachten Modell nicht möglich.
In der Literatur wird auch beschrieben, dass ein geschlossener und inaktivierter Kanal nach Repolarisierung zunächst kurzzeitig im Zustand offen vorliegt, bevor er durch die Konformationsänderung direkt nach geschlossen aktivierbar übergeht. In jedem Fall erfolgt die Wiederaktivierung nur nach einer Hyperpolarisation (oder vollständiger Repolarisation bei Herzmuskelzellen), ein Übergang inaktiviert nach offen ist bei repolarisierter Membran nicht möglich.
Nicht alle Kanäle öffnen sich gleichzeitig bei demselben Wert des Membranpotentials. Vielmehr ist die Wahrscheinlichkeit eines Kanals, in einen bestimmten Zustand überzugehen, spannungsabhängig. Aus der rein statistischen Verteilung stellt sich ein Gleichgewicht ein, so dass eine größere Zahl von Kanälen in der Summe sehr gut das oben geschilderte Modell erfüllt.
Auch ist der Zeitaufwand, um von einem Zustand in den anderen überzugehen, kanalspezifisch. Im geschilderten Natriumkanal läuft die Konformationsänderung von geschlossen nach offen in weniger als einer Millisekunde ab, während ein Kaliumkanal Zeit in der Größenordnung von 10 ms benötigt.
Abgesehen von der Spannung gibt es noch eine Reihe weiterer, oft chemische Faktoren zum Öffnen bzw. Schließen der Kanäle. Für das Aktionspotential sind davon nur noch zwei von gewisser (siehe unten) Bedeutung. Zum einen sind die einwärtsgleichrichtenden Kaliumkanäle (Kir) zwar an sich nicht regelbar. Es gibt jedoch niedermolekulare, positiv geladene Stoffe wie das Spermin, die bei ausreichender Depolarisation die Kanalporen verstopfen können (Kanalblock, Porenblock). Ein weiterer Mechanismus betrifft Kaliumkanäle, die öffnen, wenn intrazellulär Calciumionen (normalerweise intrazellulär in sehr niedriger Konzentration) an sie binden.
Ablauf
Ausgangslage
In der Ausgangslage befindet sich die Zelle in Ruhe und weist ihr Ruhemembranpotential auf. Die Natriumkanäle sind nahezu alle geschlossen, nur bestimmte Kaliumkanäle sind geöffnet, die Kaliumionen bestimmen das Ruhemembranpotential. Bei allen Ionenbewegungen wird Richtung und Stärke durch die elektrochemischen Triebkräfte für die jeweiligen Ionen bestimmt. Vor allem Natriumionen strömen schnell in die Zelle, sobald sich die Kanäle dafür öffnen.
Initiationsphase
Während der Initiationsphase muss durch einen Reiz das Membranpotential zunehmen, bis die Depolarisation einen bestimmten Schwellenwert erreicht. Das kann durch die Öffnung von postsynaptischen Ionenkanälen (Na+, Ca2+) oder durch ein elektrotonisch weitergeleitetes (Aktions)potential aus einer benachbarten Membranregion geschehen.
Erhöht sich das Membranpotential um 20 mV (beispielsweise von −70 auf −50 mV), tritt der Porenblock der Kir-Kanäle durch Spermin ein, was die nachfolgende sehr schnelle Depolarisation und das Erreichen des Schwellenwerts der Natriumkanäle ermöglicht, die sonst durch ausströmende Kaliumionen, die in Richtung des Ruhepotentials wirken würden, zumindest vermindert würden.
Aufstrich und Overshoot
Bei −60 mV fangen die spannungsabhängigen Natriumkanäle NaV an, in den offenen Zustand überzugehen. Natriumionen, die mit ihrer hohen Außenkonzentration weit von ihrem elektrochemischen Gleichgewicht entfernt sind, strömen ein, die Zelle depolarisiert, dadurch werden weitere spannungsempfindliche Kanäle geöffnet; noch mehr Ionen können einströmen: Der schnelle Aufstrich führt zum Overshoot (Umpolarisierung). Die „explosionsartige“ Depolarisierung nach Überschreiten des Schwellenwerts beruht auf positiver Rückkopplung.
Repolarisation
Noch bevor das Potentialmaximum erreicht ist, beginnen die NaV-Kanäle zu inaktivieren. Zugleich kommen die spannungsabhängigen Kaliumkanäle KV ins Spiel; K+-Ionen strömen aus der Zelle heraus. Sie haben zwar ihre Schwelle bei ähnlichen Werten, brauchen aber wesentlich länger für das Öffnen, womit sie jetzt erst langsam beginnen. Während des Maximums der Na-Leitfähigkeit sind die Kaliumkanäle gerade erst zur Hälfte geöffnet und erreichen ihr Maximum, wenn fast alle Na-Kanäle schon inaktiviert sind. Dadurch liegt das Na-Maximum etwas vor dem Spannungsmaximum, während das K-Maximum in die Phase der steilsten Repolarisation fällt.
Während der Repolarisation nähert sich das Potential wieder dem Ruhepotential an. Die KV schließen, der Porenblock der Kir wird aufgehoben, was wichtig für die Stabilisierung des Ruhepotentials ist. Die NaV-Kanäle werden langsam wieder aktiviert.
Nachhyperpolarisation
In vielen Zellen (vor allem Neuronen) ist noch eine Hyperpolarisation zu beobachten. Sie erklärt sich durch eine auch weiterhin noch erhöhte Kaliumleitfähigkeit, wodurch das Potential noch näher am Kaliumgleichgewichtspotential liegt. Die Leitfähigkeit ist höher, weil während des Aktionspotentials eingeströmte Calciumionen entsprechende Kaliumkanäle öffnen, und normalisiert sich erst, wenn der Calciumspiegel wieder absinkt. Auch eine erhöhte Pumprate der Natrium-Kalium-Pumpe kann einen Beitrag zur Hyperpolarisation leisten.
Refraktärzeit
Nach dem Abklingen des Aktionspotentials ist das Axon für eine kurze Zeit nicht erregbar. Bei den Arbeitsmyokardzellen des Herzens ist diese Phase – dort auch „Plateauphase“ genannt – besonders lang, was auf den sog. „langsamen Calcium-Einstrom“ zurückgeführt wird. (Dieser Umstand ist wichtig, um ein „Zurücklaufen“ der Erregung zu verhindern (Unidirektionalität)). Diese Dauer, die Refraktärzeit, ist bestimmt durch die Zeit, die die NaV zur Wiederaktivierung benötigen. Während der absoluten Refraktärphase kurz nach dem Overshoot, wenn die Repolarisation noch im Gange ist, können diese Kanäle überhaupt nicht wieder öffnen. Man sagt auch, der Schwellenwert liegt bei unendlich. Während der relativen Refraktärphase benötigt man stärkere Reize und erhält schwächere Aktionspotentiale. Hier bewegt sich der Schwellenwert von unendlich wieder auf seinen normalen Wert zu.
Schwellenpotential
Meist wird für die Auslösung eines Aktionspotentials das Überschreiten eines bestimmten Schwellenpotentials verantwortlich gemacht, ab dem die Natriumkanäle nach Art eines internen Vergleiches lawinenartig aktiviert werden. Trotz aller Bemühungen eine solche Feuerschwelle zu finden, kann kein fester Spannungswert angegeben werden, der ein Aktionspotential bedingt. Stattdessen feuern Neurone unter einem relativen breiten Band von auslösenden Membranspannungen. Daher ist die Neurowissenschaft von der Vorstellung eines festen Schwellenpotentials abgekommen. Systemtheoretisch lässt sich die Entstehung des Aktionspotentials am ehesten durch eine Bifurkation zwischen passiver und Aktionspotentialdynamik beschreiben, wie es beispielsweise beim Hodgkin-Huxley-Modell der Fall ist. Trotzdem ist es, auch in der Fachliteratur, durchaus üblich, weiterhin von einer Feuerschwelle zu sprechen, um den grauen Bereich zwischen Ruhe und Aktionspotential zu kennzeichnen.
Tierische Aktionspotentiale
Außer durch spannungsaktivierte Natriumkanäle können Aktionspotentiale bei Purkinjezellen in ihrer Häufigkeit durch spannungsaktivierte Calciumkanäle moduliert werden.[11][12]
Pflanzliche Aktionspotentiale
Prinzipiell sind Zellen von Pflanzen und Pilzen[5] auch elektrisch erregbar. Der Hauptunterschied zum tierischen Aktionspotential besteht darin, dass die Depolarisierung nicht durch Eintritt von positiven Natriumionen geschieht, sondern durch Ausfluss von negativen Chloridionen .[13][14][3] Zusammen mit dem darauffolgenden Ausfluss von positiven Kaliumionen, der gleichermaßen in tierischen wie in pflanzlichen Zellen die Repolarisierung bewirkt, bedeutet dies für Pflanzenzellen einen osmotischen Verlust an Kaliumchlorid, wohingegen das tierische Aktionspotential durch gleiche Mengen von Natriumeinstrom und Kaliumausstrom in der Summe osmotisch neutral ist. Die Koppelung von elektrischen und osmotischen Ereignissen beim pflanzlichen Aktionspotential [15] legt nahe, dass elektrische Erregbarkeit bei den gemeinsamen einzelligen Vorfahren von Tier- und Pflanzenzellen der Regulierung des Salzhaushalts unter veränderlichen Salinitätsbedingungen diente, während die osmotisch neutrale Fortleitung von Signalen durch tierische Vielzeller mit nahezu konstanter Salinität eine evolutionär jüngere Errungenschaft darstellt.[16] Demnach hat sich die Signalfunktion von Aktionspotentialen in einigen Gefäßpflanzen (beispielsweise Mimosa pudica) unabhängig von derjenigen in tierischen Zellen herausgebildet.
Literatur
- Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas der Physiologie. 6. Auflage, Thieme Verlagsgruppe, Stuttgart 2003, ISBN 3-13-567706-0.
Weblinks
- Aktionspotential oder das Aktionspotential – Prinzip des Aktionspotential in Wort und Animation bei fsbio-hannover.de
- Aktionspotenzial Fortleitung – Flash-Animation in 4 Stufen bei informatik.uni-ulm.de
Einzelnachweise
- ↑ Machemer H, Ogura A: Ionic conductances of membranes in ciliated and deciliated Paramecium.. In: The Journal of Physiology. 296, 1979, S. 49–60. PMID 529122.
- ↑ Taylor AR: A fast Na+/Ca2+-based action potential in a marine diatom. In: PLOS ONE. 4(3), 2009, S. e4966. PMID 19305505.
- ↑ 3,0 3,1 Beilby MJ: Action potentials in charophytes. In: Int. Rev. Cytol.. 257, 2007, S. 43–82. doi:10.1016/S0074-7696(07)57002-6. PMID 17280895.
- ↑ Sibaoka T: Excitable cells in Mimosa. In: Science. 137, 1962, S. 226. PMID 13912476.
- ↑ 5,0 5,1 Slayman CL, Long WS, Gradmann D: Action potentials in Neurospora crassa, a mycelial fungus. In: Biochimica et biophysica acta. 426, 1976, S. 737–744. PMID 130926.
- ↑ Piccolino M: Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology. In: Trends in Neuroscience. 20, Nr. 10, 1997, S. 443–448. doi:10.1016/S0166-2236(97)01101-6.
- ↑ Piccolino M: The bicentennial of the Voltaic battery (1800–2000): the artificial electric organ. In: Trends in Neuroscience. 23, Nr. 4, 2000, S. 147–151. doi:10.1016/S0166-2236(99)01544-1.
- ↑ Hodgkin AL, Huxley AF: A quantitative description of membrane current and its application to conduction and excitation in nerve. In: J. Physiol.. 117, 1952, S. 500–544. PMID 12991237.
- ↑ John P. J. Pinel, Paul Pauli: Biopsychologie. Pearson Studium; Auflage: 6., aktualis. Aufl. (29. Mai 2007), ISBN 3-8273-7217-8, S. 110.
- ↑ Robert F. Schmidt: Physiologie des Menschen: Mit Pathophysiologie. Springer Verlag, 2007, ISBN 978-3-540-32908-4, S. 88.
- ↑ E. Hosy, C. Piochon, E. Teuling, L. Rinaldo, C. Hansel: SK2 channel expression and function in cerebellar Purkinje cells. In: The Journal of physiology. Band 589, Pt 14Juli 2011, S. 3433–3440, ISSN 1469-7793. doi:10.1113/jphysiol.2011.205823. PMID 21521760. PMC 3167108 (freier Volltext).
- ↑ N. Zheng, I. M. Raman: Synaptic inhibition, excitation, and plasticity in neurons of the cerebellar nuclei. In: Cerebellum (London, England). Band 9, Nummer 1, März 2010, S. 56–66, ISSN 1473-4230. doi:10.1007/s12311-009-0140-6. PMID 19847585. PMC 2841711 (freier Volltext).
- ↑ Mummert H, Gradmann D: Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes. In: Journal of Membrane Biology. 124, 1991, S. 265–273. PMID 1664861.
- ↑ Gradmann D: Models for oscillations in plants. In: Austr. J. Plant Physiol.. 28, 2001, S. 577–590.
- ↑ Gradmann D, Hoffstadt J: Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations. In: Journal of Membrane Biology. 166, 1998, S. 51–59. PMID 9784585.
- ↑ D. Gradmann, H. Mummert: Plant action potentials. In: R. M. Spanswick, W. J. Lucas, J. Dainty: Plant Membrane Transport: Current Conceptual Issues. Elsevier Biomedical Press, Amsterdam 1980, ISBN 0-444-80192-8, S. 333–344.
| Dieser Artikel basiert ursprünglich auf dem Artikel Aktionspotential aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |

