| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Morphin
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
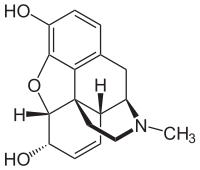
| |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Morphin | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C17H19NO3 | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| PubChem | 5288826 | ||||||||||||||
| ATC-Code | |||||||||||||||
| DrugBank | APRD00215 | ||||||||||||||
| Arzneistoffangaben | |||||||||||||||
| Wirkstoffklasse | |||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 285,34 g·mol−1 | ||||||||||||||
| Aggregatzustand |
Feststoff[1] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| pKs-Wert |
8,21 (25 °C)[1] | ||||||||||||||
| Löslichkeit |
H2O: 40 g·l−1 (20 °C, als Hydrochlorid)[1] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Toxikologische Daten | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Morphin ist ein Haupt-Alkaloid des Opiums und zählt damit zu den Opiaten. Es gehört zu der Gruppe der stark wirkenden Opioide der Stufe III im WHO-Stufenschema (Klassifizierung der Schmerztherapie) und ist als Schmerzmittel bei starken und stärksten Schmerzen zugelassen. Morphin ist das erste in Reinform isolierte Alkaloid. Es unterliegt betäubungsmittelrechtlichen Vorschriften gemäß dem Einheitsabkommen über die Betäubungsmittel.
Geschichte und Namensgebung
Morphin wurde erstmals 1804 von dem deutschen Apotheker Friedrich Wilhelm Adam Sertürner in Paderborn isoliert,[5][6] die korrekte Summenformel wurde erst im Jahre 1848 von Auguste Laurent ermittelt. Sertürner nannte den Stoff zunächst Morphium nach Morpheus, dem griechischen Gott der Träume. Erst später bekam die Droge den Namen Morphin, der fachsprachlich heute überwiegt. Bis zur Aufstellung der endgültigen Strukturformel vergingen weitere 77 Jahre.[7] Schon vor 1804 wurde Morphin von Armand Séguin und Bernard Courtois entdeckt, jedoch zunächst nur am eigenen Institut vorgestellt und erst 1816 publiziert.[8][9]
Vorkommen und Synthese
Morphin wird aus Opium, d. h. aus dem getrockneten Milchsaft des Schlafmohns (Papaver somniferum), gewonnen; der Morphinanteil im Opium liegt bei etwa zwölf Prozent, schwankt aber abhängig von der Herkunft und Vorbehandlung des Milchsafts deutlich.[10]
Die Biosynthese von Morphin – und auch aller anderen natürlich vorkommender Opiumalkaloide – erfolgt aus dem Isochinolin-Alkaloid Reticulin.[10]
Die Totalsynthese ist aufwändig und liefert geringe Ausbeuten – bei der Fuchs-Synthese beträgt sie etwa 10 %. Die Ausgangsstoffe dazu sind Phenylalanin und 4-Hydroxyphenyl-acetaldehyd. Dabei ist Norcoclaurin ein wichtiges Zwischenprodukt. Über Reticulin werden dann die Morphinan-Alkaloide gebildet, zu denen das Morphin gehört.
Die Rice-Synthese erreicht Ausbeuten von 30 % über 14 Schritten:
Gewinnung
Dem wässrigen Opiumauszug wird eine Calciumchlorid-Lösung zugesetzt. Nach Abtrennung des mekonsauren Calciums wird die Lösung eingedampft, wobei sich Morphin und Codein als Hydrochloride abscheiden. Die Hydrochloride werden erneut in eine wässrige Lösung gebracht, aus welcher das Morphin durch Zugabe von Ammoniak ausgefällt werden kann.
Heroin ist ein Derivat des Morphins: 3,6-Diacetylmorphin. Es wird durch eine chemische Reaktion (Acetylierung) aus Morphin gewonnen.
Chemische Eigenschaften
Morphin ist schwer löslich in Wasser (1:5000), etwas leichter löslich in heißem Wasser, löslich in Ethanol (1:250), schwer löslich in Ether (1:7500), in Tetrachlorkohlenstoff (1:6400), leicht löslich in alkalihaltigem Wasser.
Morphin ist in stark saurem und in alkalischem Milieu instabil. Starke Säuren lagern es zu Apomorphin um.
Auf Grund der schlechten Wasserlöslichkeit von Morphin werden arzneilich vor allem das Sulfat und das Hydrochlorid des Morphins eingesetzt, deren Wasserlöslichkeit deutlich, d. h. etwa 300-mal, besser ist als das der reinen Base. Nach der Entdeckung der schmerzstillenden Wirkung des Morphins stellte über lange Zeit die schlechte Löslichkeit von Morphin ein ernsthaftes Problem dar, da zu Injektionszwecken eine wässrige Lösung nötig ist.
Analytik
Zur zuverlässigen qualitativen und quantitativen Bestimmung von Morphin in unterschiedlichen Untersuchungsgütern wie z. B. Urin, Blut, Blutserum, Blutplasma, Haaren oder pflanzlichem Material sind adäquate Probenvorbereitungsmethoden wie z. B. Extraktionsverfahren oder die SPE erforderlich. Die gewonnenen Extrakte können durch Einsatz der Kopplung chromatographischer Trennverfahren wie z. B. der Gaschromatographie oder HPLC mit der Massenspektrometrie analysiert werden.[12][13][14][15] Die Verfahren eignen sich auch zum Einsatz bei speziellen forensischen Fragestellungen wie z. B. des Einflusses des Genusses von mohnhaltigen Produkten.[16]
Pharmakologie
Pharmakodynamik
Morphin wirkt zentral als Agonist an Opioidrezeptoren. Dadurch wird die Schmerzweiterleitung verhindert und das Schmerzempfinden des Patienten gesenkt. Im Vordergrund steht dabei die Aktivierung der μ-Rezeptoren. Zu κ-Rezeptoren hat Morphin eine geringere Affinität. Präsynaptisch führt Morphin über den Opioidrezeptor G-Protein vermittelt zu einer Abnahme des zellulären Calcium-Einstroms und damit zur Hyperpolarisation. Postsynaptisch erfolgt eine G-Protein vermittelte Aktivierung von Kaliumkanälen mit nachfolgenden Kalium-Ausstrom. Der Kaliumausstrom führt ebenso zur Hyperpolarisation und effektiven Verhinderung einer Schmerzweiterleitung.
Pharmakokinetik
Morphin weist nach oraler Gabe zwar eine gute Resorption auf, die Bioverfügbarkeit ist jedoch aufgrund des hohen First-pass-Effektes mit 20–40 % relativ gering.[17] Nach intravenöser oder intramuskulärer Applikation liegt die Bioverfügbarkeit hingegen bei nahezu 100 %, wobei die maximale Analgesie bei i. v. Gabe nach 20 Minuten, bei i. m. Gabe nach 30–60 Minuten und bei subkutaner Applikation nach 45–90 Minuten erreicht wird.[18] Die Wirkungsdauer nach intravenöser oder intramuskulärer Gabe beträgt 4–5 Stunden und ist für gewöhnlich und naturgemäß bei der (oralen) Gabe retardierter Darreichungsformen deutlich verlängert.[17] Metabolite sind z. B. das inaktive Morphin-3-Glucuronid sowie das aktive (analgetisch wirksame) Morphin-6-Glucuronid, das eine deutlich längere Wirkdauer zeigt als das Morphin selber. Andere Metabolite sind u. a. Normorphin und Codein.[17][18] Die Elimination erfolgt überwiegend renal mittels hydrophiler Konjugate. Morphin weist keinen sogenannten Ceiling-Effekt auf.[19]
Therapeutische Verwendung
Anwendungsgebiete
Schmerztherapie
Morphin wird zur Behandlung von starken und stärksten akuten und chronischen Schmerzen verwendet.
Die Behandlung mit Morphin oder anderen Opioiden bei chronischen Schmerzen sollte nach den WHO-Stufenschema, d. h. nach einem abgestuften Plan, angepasst werden: möglichst orale Verabreichung eines Morphinpräparates mit langanhaltender Wirkung in individuell angepasster Dosierung und in festgelegten zeitlichen Abständen. Da Morphin allein nicht alle Arten von Schmerz vollständig ausschaltet, ist in diesen Fällen eine Kombination mit weiteren Medikamenten nötig. Dabei unterstützen sogenannte Koanalgetika und adjuvanten Therapeutika (unter anderen Antidepressiva, Bisphosphonate, Corticosteroide, Neuroleptika) die Wirkung des Morphins. Andere Arzneimittel lindern mögliche Nebenwirkungen, wie beispielsweise Abführmittel, die gegen die häufig eintretende Darmträgheit eingesetzt werden und einer Verstopfung vorbeugen.[20]
Akute Schmerzspitzen können die zusätzliche Bedarfsgabe eines schnell wirksamen Morphins erfordern.[21]
Bei längerer Behandlung entsteht selbst bei angemessener Dosierung des Morphins oder anderen Opioiden, wie bei verschiedenen anderen Medikamenten auch, eine körperliche Gewöhnung. Ein Opioidentzug bei Beendigung der Schmerztherapie muss daher ausschleichend erfolgen (Dosisreduktion pro Woche um 30 %). Bei der Anwendung von Morphin in der Sterbephase zur Linderung von Atemnot oder Schmerzen ist dieser Aspekt aber zu vernachlässigen. Hochwirksame Medikamente wie Morphin dienen nicht der Sterbehilfe, sondern der Therapie von Beschwerden, die in der Sterbephase auftreten können. Die ärztliche Pflicht zur angemessenen Schmerzlinderung schließt die Anwendung solcher Medikamente bei bestehender Indikation ein.[22][23]
Symptomatische Therapie von Atemnot, Husten und Angst
Da Morphin auch dämpfend auf das Atemzentrum wirkt, wird es insbesondere in der Palliativmedizin zur symptomatischen Behandlung der Luftnot verwendet. Es reduziert den Atemantrieb, senkt damit den Stresspegel des Patienten, die Atmung wird ruhiger und ökonomischer, indem die durch Hyperventilation entstandene Totraumatmung reduziert wird. Eine Zulassung für diese Therapie hat Morphin nicht, so dass sie im Off-Label-Use durchgeführt wird.[24] Morphin unterdrückt den Hustenreiz (antitussive Wirkung); ein anderes Alkaloid des Opiums, Codein (chemisch gesehen Methylmorphin), wird daher als Wirkstoff gegen Husten eingesetzt. In der Akutmedizin wird Morphin auch zur Symptomlinderung bei akutem Herzinfarkt (siehe dort) eingesetzt, um den Circulus vitiosus aus Schmerzen, Luftnot, Angst, psychischem und körperlichem Stress mit Zunahme des Sauerstoffverbrauchs des Herzens zu unterbinden. Außerdem senkt Morphin durch Dilatation der venösen Kapazitätsgefäße die Vorlast und durch leichte arterielle Dilatation auch die Nachlast des Herzens.[25] Morphin bewirkt zudem eine vermehrte Histaminausschüttung, durch die der Blutdruck sinken kann.[26]
Substitutionsbehandlung
Ferner wird Morphin in der Substitutionsbehandlung (Erhaltungstherapie) von Erwachsenen mit Opioidabhängigkeit verwendet. Die Verabreichung erfolgt im Rahmen medizinischer und umfassender psychosozialer Maßnahmen mit einem oral wirksamen Präparat, das den Wirkstoff verzögert abgibt, so dass eine lang anhaltende Wirkung (Retardwirkung) resultiert.
In Deutschland wurde Morphin in dieser Indikation im April 2015 im Markt eingeführt (Handelsname Substitol).[27] Die Zulassungsstudie wurde von 2008 bis 2010 an Zentren in der Schweiz und in Deutschland durchgeführt; als Vergleichssubstanz diente DL-Methadon.[28][29] In Österreich wird retardiertes orales Morphin bereits seit längerem in der Substitutionsbehandlung eingesetzt.[30] In der Schweiz ist orales retardiertes Morphin (Sevre-Long) seit 2013 zugelassen.[31]
Nebenwirkungen
Wie bei allen stark wirkenden Opioid-Analgetika können Verstopfung, Übelkeit und Erbrechen auftreten. Ebenso kann es zu Benommenheit, Stimmungsveränderungen sowie zu Veränderungen des Hormonsystems und des autonomen Nervensystems kommen. Bei Überdosierung kann es zu Miosis, Hypoventilation und niedrigem Blutdruck kommen.
Zu Beginn der Morphintherapie kann es zu Übelkeit und Erbrechen kommen, da Morphin direkt auf das Brechzentrum im Hirnstamm wirkt. Nach einiger Zeit lässt diese Nebenwirkung meist nach. Einzig die Obstipation unterliegt keiner Gewöhnung. Bei einer Langzeitanwendung sollte daher ein Abführmittel mitverordnet werden.
Grundsätzlich gilt die Fahrtüchtigkeit als eingeschränkt. Insbesondere bei einer Neueinstellung oder Therapieumstellung ist ein Fahrverbot auszusprechen,[24] jedoch scheint nach einer angemessenen Einstellung mit retardierten Opioiden die Fahrtüchtigkeit nicht wesentlich beeinträchtigt zu sein.[32]
Aufgrund der euphorisierenden Wirkung wird Morphin insbesondere bei Anwendung schnell anflutender Medikamentenformen (Tropfen, nicht retardierte Tabletten, Injektionslösung) ein hohes Suchtpotential zugeschrieben.[33] Eine Schmerzbehandlung mit Opioiden führt nicht grundsätzlich zu einer Suchtentwicklung.[34] Allerdings kann es zu einer Toleranzentwicklung kommen, die bei erneut auftretenden Beschwerden eine weitere Dosisanpassung erfordert.
Überdosierung
Die Hauptgefahr bei der Überdosierung mit Morphin und anderen Opioiden ist die Dämpfung des Atemzentrums (Atemdepression), die zur Bewusstlosigkeit und schließlich zu einem Atemstillstand führen kann. Eine Überdosierung mit Morphin (und anderen Opioden) zeigt sich u. a. an einer vertieften und von der Frequenz her verminderten Atmung mit nur noch wenigen Atemzügen pro Minute. Bei noch ansprechbaren Patienten mit einer derart verminderten Atmung kann die ständig zu wiederholende Aufforderung, regelmäßig zu atmen, lebensrettend sein (sogenannte Kommandoatmung). Bei Verdacht auf das Vorliegen einer Morphinvergiftung muss ein Notarzt hinzugezogen werden, der als wichtigste Maßnahme für eine Wiederherstellung und Aufrechterhaltung der Atmung sorgt. Eine Morphinintoxikation kann durch die Gabe von Naloxon behandelt werden. Naloxon wirkt als kompetitiver Antagonist, verdrängt Morphin von den Opioidrezeptoren und hebt dadurch dessen Wirkung auf. Die Halbwertszeit von Naloxon liegt deutlich unter jener von Morphin, so dass der Patient zwar kurzzeitig beschwerdefrei ist, aber nach dem Nachlassen der Wirkung des Naloxons wieder Atemstillstand durch die Opiatüberdosierung droht. Wird zu viel Naloxon verabreicht, kann ein morphinabhängiger Patient von der Überdosis direkt in den Entzug übergehen.
Die für einen durchschnittlichen Erwachsenen tödliche Morphindosis liegt bei oraler Aufnahme bei 0,2 g (bis 1,5 g bei Menschen mit einer Toleranz), nach parenteraler Applikation bei 0,1 g. Allerdings können – insbesondere bei intravenöser Gabe – auch schon deutlich niedrigere Dosen lebensbedrohlich sein. Für Säuglinge können schon zwei bis drei Tropfen Opiumtinktur tödlich sein.
Eine 2013 veröffentlichte Studie zeigte, dass es in der Zeit von 1999 bis 2012 in den USA zu einer Vervierfachung von opioidinduzierten Sterbefällen durch Überdosierung im Rahmen einer Schmerztherapie kam. Parallel dazu fand sich eine Vervierfachung der Opioidverschreibungen in Folge der Bemühungen um eine bessere Schmerztherapie. Als Faktoren eines Opioidmissbrauchs bis hin zur Überdosierung fanden sich u. a. auf Seiten der Patienten eine vorbekannte Neigung zu Medikamenten- oder Alkoholmissbrauch, auf ärztlicher Seite eine zu unkritische Dauerverordnung von Opioiden nach chirurgischen Eingriffen oder bei nicht-tumorbedingten Schmerzen.[35]
Bei richtiger Anwendung von Opioiden ist aber kein einziger Todesfall in der Literatur beschrieben; Opioide gelten in der Schmerztherapie als sicherer im Vergleich zu anderen Analgetika wie ASS, Metamizol, COX-Inhibitoren und Paracetamol.[22]
Handelsnamen und Darreichungsformen
Arzneilich verwendet wird Morphin in Form seines Pentahydrats oder als Morphinhydrochlorid.
Capros (D), Compensan (A), Kapanol (D, CH), M-beta (D), M-long (D), Morixon (D), Morphanton (D), MSI (D), MSR (D), MST (D), Mundidol (A), M-retard (CH), M-Stada (D), MST-Continus (D, CH), Painbreak (D), Sevredol (D, CH), Sevre-Long (CH), Substitol (A, D), Vendal (A), und andere.
Als Darreichungsformen gibt es schnell- und langsam freisetzende Medikamente in Form von Kapseln, Tabletten, Brausetabletten, Tropfen, Granulaten, Zäpfchen sowie Injektionslösungen. Mit der umgangssprachlichen Bezeichnung „Morphinpflaster“ sind transdermale Pflaster mit anderen Opioiden (Fentanyl, Buprenorphin) gemeint.
Siehe auch
Literatur
- Waltraud Stammel, Helmut Thomas: Endogene Alkaloide in Säugetieren. Ein Beitrag zur Pharmakologie von körpereigenen Neurotoxinen. Naturwissenschaftliche Rundschau 60(3), S. 117–124 (2007), ISSN 0028-1050
- Lüllmann, Mohr, Hein: Pharmakologie und Toxikologie. Thieme, Stuttgart/New York 2006, ISBN 3-13-368516-3.
- Karow/Lang: Pharmakologie und Toxikologie. 17. Auflage. 2009, Thomas Karow Verlag, ISBN 978-1-00-002009-0.
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Sicherheitsdatenblatt für Morphine hydrochloride – Merck 29. Dezember 2007
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, S. 1083–1084, ISBN 978-0-911910-00-1.
- ↑ 3,0 3,1 Datenblatt Morphine sulfate salt pentahydrate bei Sigma-Aldrich, abgerufen am 11. April 2011 (PDF).
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Gemischen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Morphin wurde 1804 erstmals aus dem Opium isoliert, Österreichische Apothekerkammer, zugegriffen 17. November 2008
- ↑ R. J. Huxtable, S. K. Schwarz: The isolation of morphine--first principles in science and ethics. Mol Interv. 2001 Oct;1(4):189–191. Volltext (HTML) Volltext (PDF) PMID 14993340
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie. 20. Auflage. Hirzel Verlag, Stuttgart 1984, S. 778, ISBN 3-7776-0406-2.
- ↑ Patricia Swain – Bernard Courtois (1777–1838), Famed for Discovering Iodine (1811), and His Life in Paris from 1798 (PDF; 178 kB)
- ↑ 2007, American Chemical Society, Division of the History of Chemistry, 2007 Outstanding Paper Award, zugegriffen 12. November 2008.
- ↑ 10,0 10,1 Opium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Juli 2013.
- ↑ Bernd Schäfer: Naturstoffe in der chemischen Industrie, Spektrum Akademischer Verlag, 2007, S. 240, ISBN 978-3-8274-1614-8.
- ↑ F. Bévalot, C. Bottinelli, N. Cartiser, L. Fanton, J. Guitton: Quantification of five compounds with heterogeneous physicochemical properties (morphine, 6-monoacetylmorphine, cyamemazine, meprobamate and caffeine) in 11 fluids and tissues, using automated solid-phase extraction and gas chromatography-tandem mass spectrometry. J Anal Toxicol. 2014 Jun; 38 (5): S. 256–264, PMID 24790060
- ↑ G. Tassoni, D. Mirtella, M. Zampi, L. Ferrante, M. Cippitelli, E. Cognigni, R. Froldi, M. Cingolani: Hair analysis in order to evaluate drug abuse in driver's license regranting procedures. Forensic Sci Int. 2014 Aug 4; 244C: S. 16–19, PMID 25151106
- ↑ N. Fucci, G. Vetrugno, N. de Giovanni: Drugs of abuse in hair: application in pediatric patients. Ther Drug Monit. 2013 Jun; 35 (3): S. 411–413, PMID 23666584
- ↑ X. Zhang, M. Chen, G. Cao, G. Hu: Determination of morphine and codeine in human urine by gas chromatography-mass spectrometry., J Anal Methods Chem. 2013; 2013: 151934, PMID 24222889
- ↑ P. Chen, R. A. Braithwaite, C. George, P. J. Hylands, M. C. Parkin, N. W. Smith, A. T. Kicman: The poppy seed defense: a novel solution. Drug Test Anal. 2014 Mar; 6 (3): S. 194–201, PMID 24339374
- ↑ 17,0 17,1 17,2 compendium.ch 6004.
- ↑ 18,0 18,1 compendium.ch 21758.
- ↑ Karow/Lang: Pharmakologie und Toxikologie. 17. Auflage 2009, Thomas Karow Verlag, ISBN 978-1-00-002009-0.
- ↑ F. Nauck, E. Klaschik: Schmerzen. In: Leitfaden Palliative Care. Palliativmedizin und Hospizbetreuung. Hrsg. C. Bausewein, Elsevier, Urban & Fischer, München 2010, S. 369–376.
- ↑ F. Nauck, E. Klaschik: Schmerzen. In: Leitfaden Palliative Care. Palliativmedizin und Hospizbetreuung. Hrsg. C. Bausewein, Elsevier, Urban & Fischer, München 2010, S. 358, S. 369–376.
- ↑ 22,0 22,1 M. Zenz:Der Einsatz von Morphium: Zwischen Pflicht und Strafe. Dtsch Arztebl 2011; 108(12): A-641 / B-518 / C-518.
- ↑ Nationaler Ethikrat: Selbstbestimmung und Fürsorge am Lebensende.Veröffentlicht 2006.; abgerufen am 14. April 2015.
- ↑ 24,0 24,1 Matthias Thöns, Thomas Sitte (Hrsg.). ##Repetitorium Palliativmedizin: Berlin 2013, doi:10.1007/978-3-642-36997-1
- ↑ G. Lee et al.: Comparative effects of morphine, meperidine and pentazocine on cardiocirculatory dynamics in patients with acute myocardial infarction. Am J Med, 1976. 60 (7): S. 949–955.
- ↑ H. W. Striebel: Die Anästhesie: Band I. Schattauer Verlag, Stuttgart 2013, S. 155.
- ↑ dgsuchtmedizin.de: dgs-info extra zur Einführung von oralem retardierten Morphin (Substitol®) in der Substitutionsbehandlung, abgerufen am 12. August 2015.
- ↑ Drei Fragen an Prof. Christian Haasen, wissenschaftlicher Leiter der Zulassungsstudie für retardiertes Morphin in der Substitutionsbehandlung, März 2015, abgerufen am 12. August 2015.
- ↑ Die Ergebnisse der Studie orales retardiertes Morphin versus Methadon, abgerufen am 12. August 2015.
- ↑ oegabs.at: Substitution - bisherige Empfehlungen, abgerufen am 12. August 2015.
- ↑ ssam.ch: Arzneimittel Statistik, Sevre-Long, abgerufen am 12. August 2015.
- ↑ F. Nauck: Internistische praxis 2010, 50, S. 143.
- ↑ Robert M. Julien et al.: A Primer Of Drug Action. erschienen bei: Worth Publishers, 2008.
- ↑ Deutsche Hauptstelle für Suchtfragen e.V., abgerufen am 16. April 2015.
- ↑ D. Dowell et al.: Opioid Analgesics – Risky Drugs, Not Risky Patients. JAMA (2013) 309 (21): S. 2219–2220. Volltext (HTML) PMID 23700072.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Morphin aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |