| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Hydrochinon
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | Hydrochinon | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C6H6O2 | |||||||||
| CAS-Nummer | 123-31-9 | |||||||||
| PubChem | 785 | |||||||||
| DrugBank | DB09526 | |||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff[2] | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 110,11 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
286 °C[2] | |||||||||
| Dampfdruck | ||||||||||
| pKs-Wert | ||||||||||
| Löslichkeit |
löslich in Wasser: 72 g·l−1 (20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Hydrochinon (1,4-Dihydroxybenzol) ist ein Phenol und neben Brenzcatechin (1,2-Dihydroxybenzol) und Resorcin (1,3-Dihydroxybenzol) das dritte mögliche Dihydroxybenzol. Hier befinden sich die beiden Hydroxygruppen in der para-Stellung.
Entdeckung
Friedrich Wöhler erhielt 1844 bei der trockenen Destillation (> 280 °C) der Chinasäure ein Produktgemisch, das neben Benzol, Benzoesäure und Salicylsäure als Hauptbestandteil eine neue farblose Verbindung enthielt. Nach Lösen des Destillats in Wasser, Abfiltrieren der unlöslichen Anteile und Abdestillieren der leichter flüchtigen Komponenten, kristallisierte aus der zurückbleibenden Lösung zunächst Benzoesäure und aus deren Mutterlauge letztendlich Hydrochinon aus, das er durch wiederholte Umkristallisation in Form von farblosen, sechsseitigen Prismen rein erhielt.[9]
Vorkommen
Hydrochinon kommt als ca. 10%ige Lösung zusammen mit 28%igem Wasserstoffperoxid in Abwehrdrüsen der Bombardierkäfer vor. Im Verteidigungsfall wird dem Gemisch Katalase zugemischt und dem Angreifer als 100 °C heißes, ätzendes Abwehrmittel entgegengespritzt.[10][11][12] Die Blätter der Bärentraube wie auch Birnen enthalten das Glycosid Arbutin, bei dem es sich um Hydrochinon-β-D-Glucosid, also eine Verbindung von Hydrochinon mit Glucose handelt.
Darstellung
Hydrochinon kann durch die Elbs-Oxidation aus Phenol synthetisiert werden.[13]
Eigenschaften
Hydrochinon ist ein farbloser Feststoff, der in vier polymorphen Kristallformen auftreten kann. Unter Normaldruck existieren die α-, β- und γ-Form.[14][15] Die α- und β-Form kristallisieren in einem hexagonalen Kristallgitter,[3][4] die γ-Form in einem monoklinen Gitter.[15][5] Bei Raumtemperatur ist die α-Form die thermodynamisch stabile Form.[16] Die β- und γ-Form sind metastabil und können sich spontan in die α-Form umwandeln.[16] Der α-Form entspricht das kommerzielle Produkt. Die β-Form kann aus Clathraten mit kleinen Molekülen wie Methanol erhalten werden.[17][18][19][4] Die γ-Form kann über eine Sublimation[15] oder schnelle Verdampfung[5] gewonnen werden. Bei höheren Drücken oberhalb von 40 MPa kann die δ-Form als vierte Kristallform nachgewiesen werden.[16] Der Schmelzpunkt der δ-Form liegt bei 78,5 MPa bei 191 °C.[16] Der Tripelpunkt zwischen α-, δ- und flüssiger Phase liegt bei 176 °C und 15,7 MPa.[16]
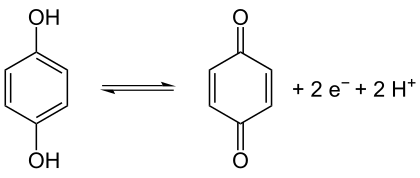
Hydrochinon ist ein stärkeres Reduktionsmittel als Brenzcatechin, da das aus Brenzcatechin entstehende o-Benzochinon energiereicher und somit ein stärkeres Oxidationsmittel ist. Ursache für Letzteres ist die elektrostatische Abstoßung der benachbarten Carbonylgruppen.
Es lässt sich durch Oxidation in Benzochinon (Chinon) überführen:
Bei dieser Reaktion entsteht als Zwischenprodukt der tieffarbige, schwer wasserlösliche Charge-Transfer-Komplex Chinhydron (nicht abgebildet).
Reaktionen
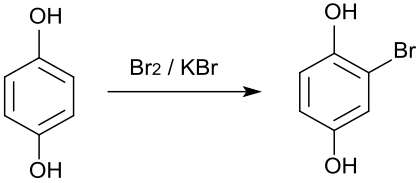
Die einfache Bromierung von Hydrochinon mit Kaliumbromid und Brom in Tetrachlorkohlenstoff führt zum Bromhydrochinon.[20]
Vollständige Bromierung zum analytischen Nachweis liefert das 2,5-Dibromhydrochinon,[21] dessen Schmelzpunkt bei 186 °C liegt.[22] Ebenfalls bekannt ist das Tetrabromhydrochinon, welches jedoch aus Benzochinon dargestellt wird.
Methylierung mit Dimethylsulfat ergibt das 1,4-Dimethoxybenzol, dessen Schmelzpunkt bei 56 °C liegt.
Eine direkte Nitrierung des Hydrochinons ist nicht möglich, da es dabei zerfällt.[23] Die Hydroxygruppen müssen daher durch Reaktion mit Essigsäureanhydrid und Schwefelsäure als Katalysator[24] mit Acetylgruppen geschützt werden, dann findet eine Nitrierung an den Positionen 2 und 6 statt. Die Verseifung des entstehenden Dinitrodiacetylhydrochinons führt schließlich zu 2,6-Dinitrohydrochinon (Schmelzpunkt 135–136 °C).[23]
Verwendung
In der Fotolabortechnik wird Hydrochinon als Reduktionsmittel zum Entwickeln von Filmen und Bildern eingesetzt. Wegen der Gefahren für Umwelt und Gesundheit gibt es Bestrebungen, die Substanz für diese Anwendungen nach Möglichkeit durch weniger riskante Stoffe zu ersetzen. Es wird auch als Inhibitor für Radikalreaktionen genutzt, um die Bildung von Etherperoxiden zu verhindern.
Die kosmetische Verwendung in Hautcremes, etwa zur Hautaufhellung, ist in den Ländern der EU verboten.[25]
Toxikologie
Es gibt keine Studien zur direkten Toxizität von Hydrochinon im Menschen. Allerdings wurde in mehreren Studien an Tieren gezeigt, dass Hydrochinon für die Niere toxisch ist.[26][27] Außerdem ist Hydrochinon immunotoxisch und spielt vermutlich auch bei der Immunotoxizität von Benzen eine bedeutende Rolle.[28]
Wenn Hydrochinon dermal aufgetragen wird kann es zu allergischen und auch systematischen allergischen Reaktionen kommen.[29]
Kanzerogenität
Zum Menschen liegen zwei Kohortenstudien vor, einmal von dänischen Lithographen und von Industriearbeitern, in denen der Zusammenhang zwischen einer Exposition mit Hydrochinon und dem Auftreten von Krebs allgemein und auch spezifischen Tumoren untersucht wurde. In keiner der beiden Studien konnte ein Zusammenhang festgestellt werden, auch wenn sich unter den Lithographen eine erhöhte Inzidenz an Melanomen zeigte.[30][31]
In Rattenversuchen konnte bei wiederholter Gabe von Hydrochinon ein erhöhtes Auftreten bestimmter Tumore in der Leber und der Niere gezeigt werden.[32]
Es wird daher angenommen, dass Hydrochinon, wie auch andere Dihydroxybenzene (z. B. Catechol) karzinogen und genotoxisch ist.[28]
Mögliche Wirkmechanismen
In Versuchen an Leberzellen führte Hydrochinon zu einer Depletion von Antioxidanzien in der Zelle, konkret von Glutathion. Außerdem konnte in der Zellkultur gezeigt werden, dass Hydrochinon DNA-Addukte bildet und die Bildung von 8-OHdG, einem Standardmarker für DNA-Schäden, erhöht. Es wird angenommen, dass diese DNA-Schäden im Zusammenhang mit der Bildung von ROS stehen.[33][32][34][35]
Metabolismus
Hydrochinon wird im Menschen hauptsächlich zu Sulfat- und Glucoronidkonjugaten verstoffwechselt. Im Rahmen dieser Stoffwechselwege entsteht neben reaktiven Intermediaten, wie zum Beispiel Semichinone und ROS, auch 1,4-Benzochinon. Diese Verstoffwechselung wird durch eine Reihe von Oxidasen katalysiert.[36][37][38] Damit ist der Metabolismus von Hydrochinon dem von Catechol ähnlich.
Gefahrenbewertung
Hydrochinon wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Hydrochinon waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, Verbraucherverwendung, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde von Italien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[39][40]
Einzelnachweise
- ↑ Eintrag zu HYDROQUINONE in der CosIng-Datenbank der EU-Kommission, abgerufen am {{{Datum}}}.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Eintrag zu CAS-Nr. 123-31-9 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ 3,0 3,1 S. C. Wallwork, H. M. Powell: The crystal structure of the α form of quinol. In: J. Chem. Soc. Perkin Trans. Band 2, 1980, S. 641–646, doi:10.1039/P29800000641.
- ↑ 4,0 4,1 4,2 S. V. Lindemann, V. E. Shklover, Yu. T. Struchkov: The β-modification of hydroquinone, C6H6O2. In: Cryst. Struct. Commun. Band 10, 1981, S. 1173–1179.
- ↑ 5,0 5,1 5,2 K. Maartmann-Moe: The crystal structure of γ-hydroquinone. In: Acta Cryst. Band 21, 1966, S. 979–982, doi:10.1107/S0365110X66004286.
- ↑ 6,0 6,1 Hydrochinon. In: Römpp Online. Georg Thieme Verlag, abgerufen am {{{Datum}}}.
- ↑ SUVA: Grenzwerte am Arbeitsplatz {{{Jahr}}} – MAK-Werte, BAT-Werte, Grenzwerte für physikalische Einwirkungen.
- ↑ Eintrag zu Hydroquinone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ F. Wöhler: Ueber das Chinon. In: Pharmaceutisches Centralblatt. Nr. 39, 1844, S. 609–615. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ H. Schildknecht, K. Holoubekal: Die Bombardierkäfer und ihre Explosionschemie. In: Angewandte Chemie. 73 (1), 1961, S. 1–7. doi:10.1002/ange.19610730102.
- ↑ Werner Nachtigall, A. Wisser: Biologisches Design. 1. Auflage. Springer-Verlag, Berlin 2005, ISBN 3-540-22789-X. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Gerhard G. Habermehl: Gift-Tiere und ihre Waffen. 5., aktual. und erweit. Auflage. Springer-Verlag, Berlin 1994, ISBN 3-540-56897-2. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ K. Elbs: Ueber Nitrohydrochinon. In: J. Prakt. Chem. 48, 1893, S. 179–185. doi:10.1002/prac.18930480123.
- ↑ W. A. Caspari: The crystal structure of quinol. Part I. In: J. Chem. Soc. 1926, S. 2944–2248. doi:10.1039/JR9262902944.
- ↑ 15,0 15,1 15,2 W. A. Caspari: The crystal structure of quinol. Part II. In: J. Chem. Soc. 1927, S. 1093–1095. doi:10.1039/JR9270001093.
- ↑ 16,0 16,1 16,2 16,3 16,4 M. Naoki, T. Yoshizawa, N. Fukushima, M. Ogiso, M. Yoshino: A New Phase of Hydroquinone and Its Thermodynamic Properties. In: J. Phys. Chem. B 103, 1999, S. 6309–6313. doi:10.1021/jp990480k.
- ↑ D. E. Palin, H. M. Powell: Hydrogen Bond Linking of Quinol Molecules. In: Nature. Band 156, 1948, S. 334. doi:10.1038/156334a0.
- ↑ D. E. Palin, H. M. Powell: The structure of molecular compounds. Part III. Crystal structure of addition complexes of quinol with certain volatile compounds. In: J. Chem. Soc. 1947, S. 208–221. doi:10.1039/JR9470000208.
- ↑ D. E. Palin, H. M. Powell: The structure of molecular compounds. Part VI. The β-type clathrate compounds of quinol. In: J. Chem. Soc. 1948, S. 815–821. doi:10.1039/JR9480000815.
- ↑ Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig/ Berlin/ Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- ↑ M. Kohn, L. W. Guttmann: Zur Kenntnis der Bromsubstitionsprodukte des Hydrochinons. In: Monatshefte für Chemie. 45 (10), 1924, S. 573–588. doi:10.1007/BF01524599.
- ↑ Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig/ Berlin/ Heidelberg 1993, ISBN 3-335-00343-8, S. 653.
- ↑ 23,0 23,1 Gustav Walther: Methylether des 2,6-Dinitrohydrochinons und einige Derivate. Dissertation. Universität Basel, 1904.
- ↑ H. Bock, S. Nick, C. Näther, J. W. Bats: Dinatrium- und Dikalium-Nitranilate: Die Cyanin-Verzerrung der Kohlenstoff-Sechsringe. In: Zeitschrift für Naturforschung B. 49, 1994, S. 1021–1030 (PDF, freier Volltext). Fehlerhafte oder fehlende Angabe in "Serie"
- ↑ https://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.results&annex_v2=II&search
- ↑ National Toxicology Program: NTP Toxicology and Carcinogenesis Studies of Hydroquinone (CAS No. 123-31-9) in F344/N Rats and B6C3F1 Mice (Gavage Studies). In: National Toxicology Program Technical Report Series. 366, 1989-10 ISSN 0888-8051, S. 1–248, PMID 12692638.
- ↑ Masa-Aki Shibata, Masao Hirose, Hikaru Tanaka, Emiko Asakawa, Tomoyuki Shirai: Induction of Renal Cell Tumors in Rats and Mice, and Enhancement of Hepatocellular Tumor Development in Mice after Long-term Hydroquinone Treatment. In: Japanese Journal of Cancer Research. 82, Nr. 11, 1991 ISSN 1349-7006, S. 1211–1219, doi:10.1111/j.1349-7006.1991.tb01783.x, PMID 1752780.
- ↑ 28,0 28,1 International Agency for Research on Cancer.: Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide.. World Health Organization, International Agency for Research on Cancer, Lyon, Frankreich 1999, ISBN 978-92-832-1271-3.
- ↑ A. Barbaud, P. Modiano, M. Cocciale, S. Reichert, J.-L. Schmutz: The topical application of resorcinol can provoke a systemic allergic reaction. In: British Journal of Dermatology. 135, Nr. 6, 1996 ISSN 1365-2133, S. 1014–1015, doi:10.1046/j.1365-2133.1996.d01-1121.x.
- ↑ J. W. Pifer, F. T. Hearne, F. A. Swanson, J. L. O'Donoghue: Mortality study of employees engaged in the manufacture and use of hydroquinone. In: International Archives of Occupational and Environmental Health. 67, Nr. 4, 1995 ISSN 0340-0131, S. 267–280, doi:10.1007/BF00409409, PMID 7591188.
- ↑ Bd Carlton, H Shah: Re: "Malignant melanoma among lithographers" by H Nielsen, L Henriksen, JH Olsen. Scand J Work Environ Health 1996;22:108--11. In: Scandinavian Journal of Work, Environment & Health. 23, Nr. 4, 1997-08 ISSN 0355-3140, S. 308, doi:10.5271/sjweh.224.
- ↑ 32,0 32,1 U. Stenius, M. Warholm, A. Rannug, S. Walles, I. Lundberg: The role of GSH depletion and toxicity in hydroquinone-induced development of enzyme-altered foci. In: Carcinogenesis. 10, Nr. 3, 1989-03 ISSN 0143-3334, S. 593–599, doi:10.1093/carcin/10.3.593, PMID 2564322.
- ↑ Junzo Suzuki, Yuichiro Inoue, Shizuo Suzuki: Changes in the urinary excretion level of 8-hydroxyguanine by exposure to reactive oxygen-generating substances. In: Free Radical Biology and Medicine. 18, Nr. 3, 1995-03-01 ISSN 0891-5849, S. 431–436, doi:10.1016/0891-5849(94)00152-A (http://www.sciencedirect.com/science/article/pii/089158499400152A).
- ↑ G. Lévay, W. J. Bodell: Role of hydrogen peroxide in the formation of DNA adducts in HL-60 cells treated with benzene metabolites. In: Biochemical and Biophysical Research Communications. 222, Nr. 1, 1996-05-06 ISSN 0006-291X, S. 44–49, doi:10.1006/bbrc.1996.0695, PMID 8630072.
- ↑ G. Levay, K. Pongracz, W. J. Bodell: Detection of DNA adducts in HL-60 cells treated with hydroquinone and p-benzoquinone by 32P-postlabeling. In: Carcinogenesis. 12, Nr. 7, 1991-07 ISSN 0143-3334, S. 1181–1186, doi:10.1093/carcin/12.7.1181, PMID 2070482.
- ↑ World Health Organization: Hydroquinone. In: Environmental Health Criteria. 157, Genf 1994.
- ↑ B. A. Hill, H. E. Kleiner, E. A. Ryan, D. M. Dulik, T. J. Monks: Identification of multi-S-substituted conjugates of hydroquinone by HPLC-coulometric electrode array analysis and mass spectroscopy. In: Chemical Research in Toxicology. 6, Nr. 4, 1993-07 ISSN 0893-228X, S. 459–469, doi:10.1021/tx00034a012, PMID 8374043.
- ↑ Vangala V. Subrahmanyam, Prema Kolachana, Martyn T. Smith: Metabolism of hydroquinone by human myeloperoxidase: Mechanisms of stimulation by other phenolic compounds. In: Archives of Biochemistry and Biophysics. 286, Nr. 1, 1991-04-01 ISSN 0003-9861, S. 76–84, doi:10.1016/0003-9861(91)90010-G (http://www.sciencedirect.com/science/article/pii/000398619190010G).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Hydroquinone.
| Dieser Artikel basiert ursprünglich auf dem Artikel Hydrochinon aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |