| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Choanozoa
| Choanozoa | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

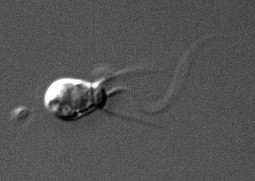
Oben: Eine Zellkolonie des Choanoflagellaten Salpingoeca rosetta. Ein mariner Schwamm. Eine Rippenqualle der Art Bathocyroe fosteri. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Choanozoa | ||||||||||||
| Brunet & King, 2017 |
Zu der Gruppe der Choanozoa gehören alle Tiere (Metazoa) und ihre nächsten Verwandten, die Kragengeißeltierchen (Choanoflagellata). Es zählen sämtliche Lebensformen dazu, die den Zelltyp der Kragengeißelzelle (Choanocyt) ausbilden oder deren Vorfahren wahrscheinlich einmal diesen Zelltyp ausgebildet hatten.
Unter allen heutigen Tieren werden Kragengeißelzellen nur bei den Schwämmen (Porifera) vorgefunden.[1] Bis auf wenige Ausnahmen[2] ernähren sich diese Organismen von Bakterien,[3] die sie mit Hilfe der Kragengeißelzellen aus dem Wasser filtern.[4] Die übrigen Tiere haben keine Kragengeißelzellen. Stattdessen besitzen viele von ihnen recht ähnliche Zelltypen.[5]
Bei den Kragengeißeltierchen handelt es sich um mikroskopisch kleine Echtzeller aus Kragengeißelzellen. Ihre eiförmigen bis rundlichen Zellkörper haben wenige bis höchstens einige zehner Mikrometer Durchmesser.[6] Kragengeißeltierchen bilden sowohl freischwimmende als auch sessile Formen[7][8] und kommen als Einzelzellen oder in kleinen Zellkolonien vor.[9] Sie gedeihen in den Meeren und im Brackwasser, sowie in Süßgewässern einschließlich Bodenwässern und Aquiferen.[10] Kragengeißeltierchen ernähren sich als Filtrierer[11] von Bakterien[12] und Viruspartikeln.[13]
Die Stammesgeschichte der Choanozoa reicht vermutlich fast eine Milliarde Jahre zurück,[14] bisher wurden allerdings für die ersten paar hundert Millionen Jahre keine oder bloß umstrittene fossile Belege erbracht.[15][16]
Begriff
Im Jahr 1765 veröffentlichte der britische Naturforscher John Ellis eine Untersuchung an Schwämmen. Ihm fiel auf, dass sie einen Nahrungsstrom auf aktive Weise erzeugten und dabei den Bereich um ihre zentrale Ausstromöffnung (Osculum) selbstständig bewegten. Damit lieferte Ellis’ Veröffentlichung zwei Belege, um Schwämme gut begründet in die Gruppe der Tiere zu ordnen.[17][18] Der deutsche Naturforscher Christian Gottfried Ehrenberg beschrieb im Jahr 1831 mit dem „vielköpfigen Säulenglöckchen“ einen Mikroorganismus,[19] der mit einiger Wahrscheinlichkeit heute der Art Codonosiga botrytis zugeordnet wird. Ehrenberg hatte die Kragengeißeltierchen entdeckt.[20][21] Eine erste eindeutige Abbildung folgte zwar erst über zwei Jahrzehnte später durch den deutschen Botaniker Georg Fresenius,[22][23][24] doch bereits kurz nach Ehrenbergs Veröffentlichung erkannte der französische Naturforscher Félix Dujardin die große Ähnlichkeit zwischen diesen Organismen und bestimmten Zellen von Schwämmen. Er taufte jene Zellen Choanocyten.[25] Mit Choanoflagellaten und Choanocyten beschäftigte sich etwas später der US-amerikanische Biologe Henry James Clark. Er war der erste, der sich für eine verwandtschaftliche Beziehung zwischen Kragengeißeltierchen und Schwämmen aussprach.[26] Sieben Jahre danach stellte schließlich der britische Biologe Thomas Henry Huxley die Porifera einerseits an die Basis der Metazoa und andererseits gleichzeitig allen übrigen Tieren gegenüber.[27][18][28]
Schon im letzten Drittel des 19. Jahrhunderts war bekannt, dass die Schwämme einfach gebaute Tiere darstellten und dass sie mit den Kragengeißeltierchen wahrscheinlich in enger verwandtschaftlicher Beziehung standen. Demzufolge waren bereits die Voraussetzungen gegeben, um Tiere und Kragengeißeltierchen als eine gemeinsame geschlossene Abstammungsgemeinschaft anzusehen. Diese Gemeinschaft erhielt jedoch für über einhundertzwanzig Jahre keinen eigenen Namen. Mit dem Beginn der Phylogenomik wurden beständig weitere Belege geliefert, die für ein Monophylum aus Choanoflagellata und Metazoa sprachen.[29][30][31]
Um das Monophylum zu benennen, wurde versuchsweise vorgeschlagen, die Kragengeißeltierchen schlicht ebenfalls als Tiere anzusehen.[32] Daraus hätte eine Gruppe namens „Animalia“ resultiert, die in sich Choanoflagellata und Metazoa gesammelt hätte. Diese Möglichkeit fand keine weite Verbreitung. Denn das Wort Animalia hatte sich längst mit einer anderen Wortbedeutung etabliert, es wird als Synonym für das Wort Metazoa benutzt.[33] Sehr häufig blieb das Monophylum schlicht namenlos. Nur gelegentlich wurden weitere Namensvorschläge unterbreitet, die „Choanimal“[34] und „Apoikozoa“[35] hießen. Beide setzten sich nicht durch. Im Jahr 2017 brachten die US-amerikanischen Biologen Thibaud Brunet und Nicole King das Wort „Choanozoa“ als neue Bezeichnung für die Klade aus Kragengeißeltierchen und Tieren ein.[36] Es war zwar schon einmal acht Jahre vorher mit der genau gleichen Wortbedeutung in einer Abbildung aufgetaucht,[37] hatte damals jedoch keine weitere Aufmerksamkeit erfahren. Außerdem war „Choanozoa“ in den Jahren 1981 und 1983 von dem britischen Evolutionsbiologen Thomas Cavalier-Smith als eine Benennung für einen Stamm vorgeschlagen worden, der ausschließlich die Kragengeißeltierchen umfasst hätte.[38] Dadurch war die Bezeichnung seit den 1980ern längst zu einem weitgehenden Synonym für das Wort Choanoflagellata geworden. Im Wortsinn von Cavalier-Smith wurde „Choanozoa“ bis in die 2000er Jahre verwendet.[39] Dann stellten Thibaut Brunet und Nicole King ihre neue Bedeutung des Begriffs vor. Sie argumentierten außerdem, dass „Choanozoa“ in der Verwendung von Cavalier-Smith ein Paraphylum beschreiben würde. Denn die Bezeichnung hätte in ihrer damals aktuellsten Fassung aus dem Jahr 2008 noch zwei weitere Einzeller-Gruppen einbezogen, die Ichthyosporea und die Filasterea.[36] Die revidierte Klassifikation der Eukaryoten aus dem Jahr 2019 griff den Nomenklatur-Vorschlag von Thibaud Brunet und Nicole King auf. Ihr zufolge trägt die monophyletische Gruppe aus Kragengeißeltierchen (Choanoflagellata) und Tieren (Metazoa) nun den Namen Choanozoa.[40]
Merkmal
Das zelluläre Merkmal der Choanozoa besteht in der Kragengeißelzelle. Es wird häufig als ein gemeinsames abgeleitetes Merkmal (Autapomorphie) angesehen.[41] Die Zelle trägt an einem Zellpol eine einzige Geißel. Sie ist umgeben von dem namensgebenden „Kragen“ – einem Kranz aus Stereovilli, die zwischen sich einen feinen Vorhang aus Schleim aufspannen.[42] Das Zusammenspiel von Geißel und Kragen dient der filtrierenden Ernährung. Die schlagende Geißel erzeugt einen Wasserstrom. Das zuströmende Wasser tritt durch den Schleimvorhang. Im Wasser befindliche Nahrungspartikel werden vom Schleim aufgehalten, anschließend durch Filopodien eingefangen[43] und daraufhin mittels Endozytose von der Kragengeißelzelle aufgenommen.[44]
Kragengeißeltierchen sind aus einer Kragengeißelzelle aufgebaut, daneben gibt es auch kleine Zellkolonien aus mehreren Kragengeißeltierchen.[9] Im Gegensatz zu den Kragengeißeltierchen bestehen Tiere aus vielen Zellen. Unter ihnen besitzen die Schwämme die Choanocyten als einen von mehreren Zelltypen.[45] Bei den übrigen Tieren erfuhren die Kragengeißelzellen wahrscheinlich verschiedene Abwandlungen oder gingen im Verlauf der Evolution gänzlich verloren.[1]
Häufig wird davon ausgegangen, dass die Kragengeißelzelle vom letzten gemeinsamen Vorfahren aller heutigen Choanozoa entwickelt worden ist.[46] Das würde heißen, dass die Kragengeißelzellen der Kragengeißeltierchen und die Kragengeißelzellen der Schwämme miteinander homolog sind. Trotz aller großen Ähnlichkeiten besitzen beide Zelltypen aber auch eine ganze Reihe feiner Unterschiede. Solche Verschiedenheiten können Gründe liefern, um die Homologie der Zelltypen für weniger überzeugend zu halten.[47] Vielleicht konnten sich die beiden Kragengeißelzellen auch unabhängig voneinander konvergent entwickeln.[48][49]
Systematik
Äußere Systematik der Choanozoa
| |
| |
| Innere Systematik der Choanozoa | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Gemäß phylogenomischer Studien besteht die Verwandtschaft der Choanozoa aus Einzellern von sehr vielgestaltigem Aussehen.[50] Das Schwestertaxon stellen die Gruppe der Filasterea. Mit ihnen bilden sie die Abstammungsgemeinschaft der Filozoa. Die Filozoa werden mit den Teretosporea zusammengefasst zu den Holozoa.[51][52] Zu den Teretosporea gehören wiederum die häufig parasitisch lebenden Ichthyosporea und die Pluriformea.[53] Von der letztgenannten Gruppe wurden bisher nur ein mariner Einzeller der Gattung Corallochytrium[54] und ein limnischer Einzeller das Gattung Syssomonas entdeckt.[55] Diese aktuelle Systematik ersetzt eine etwas ältere und konkurrierende Hypothese, nach der die Pluriformea nicht als Teil der Teretosporea aufgefasst werden, sondern als Schwestertaxon der Filozoa.[56]
Die Choanozoa selbst gliedern sich in Kragengeißeltierchen und Tiere. Jede der beiden Gruppen kann für sich wiederum zweigeteilt werden.[57][58] Choanoflagellaten der ersten Ordnung heißen Craspedida. Sie umhüllen ihre Zellen mit organischen Verbindungen, die meistens eine Theca formen. Wenige überziehen sich aber auch mit einem feinen Schleimfilm, der in ihrem Fall als Glykokalyx bezeichnet wird. Kragengeißeltierchen der zweiten Ordnung werden Acanthoecida genannt. Sie umgeben ihre Zellen mit einem Spangenkorb, der vor allem aus Siliciumdioxid aufgebaut wird und Lorica heißt.[59]
Während Kragengeißeltierchen nur als Einzeller oder in winzigen Zellkolonien leben, entwickelten Tiere eine eigene Form von Vielzelligkeit.[60] Ihre Körper bestehen aus vielen bis sehr vielen Zellen und immer aus mehreren differenzierten Zelltypen.[61] Die zwei Gruppen der Tiere[62][63] umfassen wahrscheinlich einerseits die Schwämme (Porifera) und möglicherweise andererseits die Epitheliozoa.[15] Die Zellverbände der Schwämme haben kaum Ähnlichkeiten mit den Geweben der übrigen Tiere.[64] Demhingegen differenzieren alle Epitheliozoa als gemeinsames Merkmal ein Deckgewebe. Die Deckgewebe-Zellen sind untereinander mit Hilfe von Desmosomen in sogenannten Zonulae Adhaerentes fest verbunden.[65] Die Vielzelligkeit der Tiere stellt einen gänzlich eigenständigen evolutionären Weg dar und entstand konvergent zu den anderen Vielzelligkeiten der Pilze, Schleimpilze, Eipilze, Armleuchteralgen, Landpflanzen, Rotalgen und Braunalgen.[66]
Obwohl die Epitheliozoa keine Choanocyten ausdifferenzieren, gehören sie zu den Choanozoa. Das liegt daran, dass das Taxon der Choanozoa in erster Linie phylogenomisch bestimmt wird. Erstens werden wegen Gemeinsamkeiten in ihren Genomen die Kragengeißeltierchen mit den Tieren als Choanozoa zusammengefasst. Zweitens werden die Epitheliozoa gemeinsam mit den Schwämmen als Tiere identifiziert. Demzufolge gehören alle Tiere – also sämtliche Tiere einschließlich der Epitheliozoa – gleichzeitig auch zu den Choanozoa. Insgesamt weisen die Choanozoa untereinander größere genomische Ähnlichkeiten auf als mit allen anderen Lebensformen.[29][30][31]
Evolution
Die Evolution der Choanozoa ist ein Teil der Evolution der Tiere. Aus der Entwicklung stechen zwei Ereignisse besonders heraus. Das erste besteht in der Ausformung der charakteristischen Kragengeißelzellen,[46][49] das zweite in der Ausbildung der tierischen Variante einer Vielzelligkeit.[67][68] Beide Ereignisse geschahen wahrscheinlich mit fragilen einzelligen Lebensformen beziehungsweise mit weichen und sehr wenigzelligen Organismen.[46][67] Sie fanden möglicherweise schon vor mehr als 900 Millionen Jahren im unteren Proterozoikum statt[14] und hinterließen anscheinend keine fossilen Spuren.
Urchoanozoa
Falls die Kragengeißelzelle als gemeinsames ursprüngliches Merkmal aller Choanozoa angesehen wird, hätte die Evolution der Choanozoa mit der Entwicklung der Kragengeißelzelle begonnen. Dies hätte innerhalb einer Population einfach begeißelter Einzeller aus der Gruppe der Filozoa geschehen müssen.[46] Vermutlich besaßen jene Organismen eine Form von Filopodien, für die der Name „Filodigiti“ vorgeschlagen worden ist.[46] Es handelt sich um fadenartige und stets unverzweigte Zellausläufer, die auf ihrer gesamten Länge die gleiche Dicke aufweisen und sich an den Enden nicht verjüngen.[69] Filopodien kommen bis heute bei vielen Einzellern und bei bestimmten Zelltypen gewisser Vielzeller vor.[70][71] Auch rezente Choanoflagellaten bilden Filopodien.[72] Solche Zellausläufer erhalten ihre Form durch ein inneres Gerüst aus Mikrofilamenten. Die Filamente bestehen aus zehn bis dreißig parallelen Strängen des Strukturproteins Aktin.[73] Möglicherweise wurden einige Filopodien verkürzt zu Stereovilli. Die Stereovilli wurden ringförmig um die Geißel angeordnet und formten den Kragen der Kragengeißelzelle.[46] So könnten die Urchoanoza die typischen Kragengeißelzellen evolviert haben.[1] Wahrscheinlich lebten sie sessil und ähnelten heutigen Kragengeißeltierchen aus der Gruppe der Craspedida.[46] Gemäß einer molekularen Uhr könnten sich die Urchoanozoa vor ungefähr 980 Millionen Jahren von den übrigen Filozoa getrennt haben.[14] Die Erde befand sich in der neoproterozoischen Periode des Toniums und der Superkontinent Rodinia begann in kleinere Landmassen zu zerbrechen.[74] Der Sauerstoff-Gehalt der Erdatmosphäre belief sich auf weniger als einem Hundertstel des heutigen Werts.[75]
Cadherine
Innerhalb der Choanozoa entwickelte sich ein Weg zur Vielzelligkeit. Nach der molekularen Uhr könnte dieses Ereignis vor gut 930 Millionen Jahren stattgefunden haben.[14] Diese Vielzelligkeit basiert entscheidend auf bestimmten Adhäsionsproteinen aus der Gruppe der Cadherine. Die Eiweiße sind in der Zellmembran verankert und ragen hinaus in den Extrazellularraum. Dort binden sie mit den Cadherinen benachbarter Zellen. Auf diese Weise können vielzellige Verbände entstehen.[76] Die Gene für die Proteinbiosynthese der ersten Cadherine entstanden bei holozoischen Einzellern, noch bevor sich die Urchoanozoa entwickelt hatten.[77] Mikrofossilien der Gattung Bicellum stellen vermutlich Zellaggregate solcher eigentlich einzellig lebenden Organismen dar. Vor ungefähr einer Milliarde Jahren konnten sie sich mit Hilfe ihrer Cadherine zu vorübergenden Zell-Zusammenballungen verbinden.[78] Die Evolution der Cadherine schritt weiter voran. Ihre Gene duplizierten und diversifizierten und tauschten Gensequenzen für Proteindomänen mit anderen Genen.[79] Wahrscheinlich kam es auch zu einem horizontalen Gentransfer mit Prokaryoten. Es wurde die Gensequenz einer Proteindomäne übertragen, die bei heutigen Bakterien der Gattung Clostridium im Cellulosomen vorkommt. Dieser Enzymkomplex bewerkstelligt den enzymatischen Cellulose-Abbau.[80] Die Urchoanoza hatten bereits Cadherine von drei Proteinfamilien entwickelt.[81] Heute werden diese Eiweiße selbst von den einzellig lebenden Choanoflagellaten der Gattung Monosiga synthetisiert.[76] Somit sollten Cadherine ursprünglich nicht zum Zusammenhaften von Zellen gedient, sondern andere Funktionen besessen haben.[80] Das änderte sich, als die ersten klassischen Cadherine evolvierten. Die klassischen Cadherine stellten eine weitere und neue Familie der Cadherine dar.[76] Erst diese neuen Eiweiße gestatteten dauerhafte Zellzusammenhalte und somit Vielzelligkeit.[46] Tatsächlich finden sich heute die Gene der klassischen Cadherine ausschließlich in den Genomen von Tieren.[82] Die Zelladhäsion der klassischen Cadherine ermöglichte die Evolution der vielzelligen Tiere aus Choanoflagellaten.[83][84] Wahrscheinlich stellte Vielzelligkeit eine Angepasstheit gegen Fressfeinde dar.[85] Dies konnte in Experimenten belegt werden. Zum Beispiel wurden einzellige Grünalgen der Art Scenedesmus acutus in einem Aquarium gehalten. In ihr Becken wurden dann Wasserflöhe der Gattung Daphnia gesetzt, die sich von den Grünalgen ernährten. Nach mehreren Tagen wurde beobachtet, dass die Grünalgen zunehmend Zellkolonien bildeten.[86] In einem anderen Experiment wurden einzellige Grünalgen der Art Chlamydomonas reinhardtii mit Fressfeinden der Art Paramecium tetraurelia zusammengebracht. Nach fünfzig Wochen hatten sich in zwei von fünf Experimentansätzen dauerhafte und klumpige Verbände mit vielen Chlamydomonas-Zellen formiert.[87] Die Neigung zur Bildung solcher Zellverbände ist vererbbar.[88] Sie nehmen ein größeres Volumen ein und erschweren es somit ihren Fressfeinden, festgehalten und verdaut zu werden.[89]
Urmetazoa
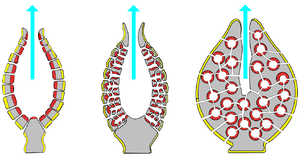
Nach einer modernen Hypothese erfolgte der Übergang von den Kragengeißeltierchen zu den Tieren durch bestimmte Zellkolonien aus der Stammgruppe der Choanoflagellaten, die klassische Cadherine synthetisieren konnten. Durch diese Eiweiße wären die einzelnen Zellen fest miteinander verbunden gewesen. Sie hätten eine einzellige Schicht gebildet. Die Zellschicht hätte sich wie die Haut einer Blase um einen flüssigkeitsgefüllten Hohlraum gelegt, dem ersten Mesohyl. Vermutlich hätte die Zellkolonie einem festen Untergrund aufgesessen. Die Verbindung zwischen Zellkolonie und Untergrund hätte die Evolution eines neuen Zelltyps aus spezialisierten Haltezellen forciert haben können, den ersten Pinacocyten. Zusammengenommen hätten solche Organismen einerseits mit Choanocyten und Pinacocyten zwei Zelltypen besessen und andererseits in sich jeweils ein zentrales Mesohyl geborgen.[67]
Gemäß einer älteren Hypothese begann der Weg zur Vielzelligkeit nicht mit einer sessilen, sondern mit einer kugelförmigen planktonischen Zellkolonie aus Stammgruppen-Choanoflagellaten. Die Zellen hätten sich lückenlos einander gelagert. Auf diese Weise hätten sie einen zentralen, flüssigkeitsgefüllten Hohlraum umfasst. Dieses Stadium der Hohlkugel wird „Choanoblastaea“ genannt. Anschließend wären Zellen aus der Hülle in den zentralen Hohlraum gewandert und zu anderen Zelltypen differenziert. Es hätte sich die „fortgeschrittene Choanoblastaea“ gebildet, eine mit unterschiedlichen Zelltypen ausgefüllte Zellkolonie. Die Zellkolonie hätte sich daraufhin auf den Untergrund gesetzt und wäre sessil geworden.[68][90] Nach beiden Hypothesen hätten die sessilen Organismen extrem einfach gebauten Abschnitten der Wandungen heutiger Schwämme geähnelt.[67] Tatsächlich wird heutzutage vielfach davon ausgegangen, dass die ersten Tiere, die Urmetazoa, zu den Schwämmen gehörten.[62][63]
Die zwei vorgestellten Hypothesen fordern ein Duo entscheidender Schritte für die Evolution von Kragengeißeltierchen zu frühen Schwämmen. Erstens entwickelte sich eine dauerhafte Mehr- bis Vielzelligkeit, die zweitens unterschiedlich differenzierte Zelltypen umfasste. Für beide Schritte wurden Entsprechungen bei heutigen Kragengeißeltierchen entdeckt. Individuen der Art Salpingoeca rosetta aus der Ordnung der Craspedida können zu fünf klar unterscheidbaren Kragengeißelzelltypen (Morphotypen) differenzieren.[91][92] Es wird auch ein Kragengeißelzelltyp gebildet, der mehr- bis vielzellige und rosettenförmige Zellkolonien ausformt.[93] Der Reiz für die Differenzierung zum Kragengeißelzelltyp der Rosetten-Kolonien besteht aus dem Stoff rosette inducing factor (RIF-1). Bei RIF-1 handelt es sich um ein Sulfonolipid.[94] Es wird von Bakterien der Gattung Algoriphagus sowie nahe verwandten Organismen aus dem Bakterienstamm der Bacteroidetes produziert und möglicherweise ins Wasser abgegeben.[95] Die Bakterien dienen Salpingoeca rosetta als Nahrung. Wahrscheinlich können die Rosetten-Kolonien ein Bakterienvorkommen effektiver verzehren, als dies einer einzelnen Kragengeißelzelle möglich wäre.[96] Die Rosetten-Kolonie besitzt Ähnlichkeit zum embryonalen Morula-Stadium der Tiere.[97] Darüber hinaus können einzelne Kragengeißelzellen der Art Salpingoeca rosetta ihre äußere Zellgestalt grundlegend verändern (Transdifferenzierung).[98] Die Gestaltveränderung erfolgt auf reversible Weise, sie kann also auch wieder rückgängig gemacht werden.[99] Meistens innerhalb weniger Minuten werden die Kränze aus Stereovilli und die Geißeln in die Zellleiber zurückgezogen und abgebaut. Die Zellen verlieren ihre rundlichen Gestalten. Sie wandeln sich zu amöboiden Zellen.[98] Die Umwandlungen finden statt, wenn die Kragengeißeltierchen räumlich stark beengt werden.[100] Ihre zweite Gestalt befähigt sie zu amöboiden Bewegungen, mit denen sie aus den Beengungen kriechen können.[101] Transdifferenzierungen zu amöboiden Zellen wurden noch an fünf weiteren Kragengeißeltierchen-Arten beobachtet.[102]
Auf der einen Seite differenzieren rezente Choanoflagellaten zu wenigen unterschiedlichen Kragengeißelzelltypen.[91] Die Kragengeißelzellen transdifferenzieren zu amöboiden Zellen. Die amöboiden Zellen transdifferenzieren wieder zu Kragengeißelzellen.[99] Auf der anderen Seite besitzen heutige Schwämme wenige unterschiedliche Schwammzelltypen. Zu den Schwammzelltypen gehören die amöboiden Archaeocyten. Die Archaeocyten differenzieren zu den übrigen Schwammzelltypen. Zu den übrigen Schwammzelltypen gehören auch Kragengeißelzellen. Diese Kragengeißelzellen transdifferenzieren wieder zu Archaeocyten.[103] Das Muster der exprimierten Gene in den Archaeocyten der Schwämme ähnelt sehr jenem Muster, das in den Kragengeißelzellen der Kragengeißeltierchen vorliegt. Andererseits unterscheiden sich die Genexpressionsmuster von Kragengeißeltierchen-Kragengeißelzellen und Schwamm-Kragengeißelzellen in viel stärkerem Maße voneinander.[104] Die Beobachtungen führten zu einer weiteren Hypothese bezüglich der Urmetazoa. Sie hätten nicht als Kragengeißelzellkolonien begonnen. Stattdessen wären ihre Körper aus Verbänden eines Zelltyps aufgebaut gewesen, der sich in weitere Zelltypen transdifferenzieren konnte – wie es in ähnlicher Weise heute anhand der Archaeocyten nachvollzogen werden kann.[105] Als einer jener weiteren Zelltypen hätten sich dann wieder Kragengeißelzellen etabliert. Aus dieser dritten Hypothese würde allerdings auch folgen, dass die Kragengeißelzellen der Choanoflagellata und die Choanozyten der Schwämme miteinander nicht direkt homolog wären.[106]
Frühe Fossilien
Ein Mangel an Fossilien erschwert die Rekonstruktion der Stammesgeschichte der Choanozoa für hunderte Millionen Jahre.[107] Zwar wurde eine Reihe möglicher Tier-Fossilien beschrieben, aber keiner dieser vermeintlichen Schwämme konnte allgemein überzeugen.[108] Als erste weniger umstrittene Belege der Choanozoa erweisen sich Versteinerungen von Tieren, die aus den letzten Jahrmillionen kurz vor Anbruch des Phanerozoikums kommen.[109]
Tonium
Im Gegensatz zu jenen hypothetischen Urmetazoa besitzen voll entwickelte Schwämme komplexere Baupläne. Sie verfügen über ein paar Zelltypen mehr. Ihre Körper erreichen makroskopische Ausmaße und werden häufig (wenn auch nicht immer) gestützt von einem Gerüst aus harten Skelettnadeln, den Schwammspicula.[110] In ihren dünnen Außenwänden befinden sich kleine Poren, die Ostia. Durch sie strömt Wasser ein. Es gelangt danach in den kelchartigen, zentralen Suboscularraum und wird anschließend durch das mittig oben gelegene Osculum wieder ausgestoßen.[111] Möglicherweise könnten Reste einer frühen Form dieses Bauplans fossil erhalten geblieben sein. Die ältesten stammen aus der Erdzeitperiode des Toniums.
Vermiforme Mikrostrukturen
In der Stone-Knife-Formation (Nordwest-Kanada) wurden fossile Stromatolithen gefunden, die von Cyanobakterien aufgebaut worden waren. Das Alter dieser Flachwasserstrukturen wurde auf ungefähr 890 Millionen Jahre datiert. Unmittelbar auf und neben den Stromatolithen und an ihren Seiten wurden sogenannte vermiforme Mikrostrukturen entdeckt. Es handelt sich um kalkige Spuren von unregelmäßigen Netzen aus winzigen Röhren, die jeweils einige Millimeter bis wenige Zentimeter Länge erreichten. Die vermiformen Mikrostrukturen wurden möglicherweise von keratosen („hornigen“) Hornkieselschwämmen (Demospongiae) hinterlassen. Es waren Schwämme, die kein stützenden Gerüst aus harten Schwammspicula aufbauten, sondern einzig aus dem Strukturprotein Spongin.[112] Keratose Hornkieselschwämme kommen noch in heutigen Meeren vor, auch wenn sie erheblich größere Körpermaße erreichen. Der gewöhnliche Badeschwamm (Spongia officinalis) gehört zu ihnen.[113] Vermutlich beschränkte sich das Areal jener sehr frühen Schwämme auf das flache Wasser in größter Nähe zu den Stromatolithen, weil dort die Cyanobakterien durch ihre oxygene Photosynthese überlebenswichtiges Sauerstoffgas (O2) bereitstellten. Während alle anderen Zonen der Meere noch so gut wie sauerstofffrei waren, konnten die Schwämme mit den hiesigen, wenn auch immer noch sehr geringen Sauerstoffkonzentrationen überleben.[114]
Otavia
Noch weitere Frühformen des Schwamm-Bauplans könnten fossil erhalten geblieben sein und besitzen ein Alter von knapp 760 Millionen Jahren. Sie wurden in marinen Flachwasser-Sedimentgesteinen Namibias gefunden[115] und erhielten den Gattungsnamen Otavia. Die winzigen Fossilien wurden höchstens fünf Millimeter lang und besitzen entfernt ei- oder kugelförmige Gestalt. Ihre dünnen Wände sind durch viele winzige Öffnungen durchlöchert, die als Ostia interpretiert wurden. Dazu treten mehrere größere Aussparungen, die als Oscula angesehen werden könnten.[116] Insgesamt jedoch scheint es nicht unbedingt naheliegend, Otavia als frühen Schwamm zu deuten. Vielleicht handelt es sich bloß um Körner aus Calciumphosphat, die von Sand aufgeraut, durchlöchert und ausgehöhlt worden sind.[117]
Cryogenium
Während der Existenzphase von Otavia[116] wechselte die Erde in die Periode des Cryogeniums. Vor 717 Millionen Jahren setzte die Sturtische Eiszeit ein, die in wenigen tausend bis einigen zehntausend Jahren den Planeten fast vollständig mit Eis überzog.[118] Sie dauerte 47 Millionen Jahre lang. Auf sie folgte 20 Millionen Jahre später nochmals die Marinoische Eiszeit, die für etwa 5 Millionen weitere Jahre in ähnlicher Weise fast die gesamte Erde unter Eis verschwinden ließ.[119] Die Schwämme mussten sich an die harschen Umweltbedingungen anpassen. Zwar hatte sich kurz vor Beginn der Cryogeniums in den Ozeanen eine dünne oberflächennahe Schicht mit leicht oxygeniertem Wasser etabliert.[120] Doch im Dunkel unter den mächtigen geschlossenen Eisdecken verbrauchten die Organismen schnell den spärlichen Sauerstoff, so dass bald größte Sauerstoffarmut herrschte.[119] Vielleicht überlebten die Schwämme am unteren Ende von Gletscherspalten, die bis zum Meerwasser hinabreichten oder sie beschränkten ihre Areale auf jene kleinräumigen Zonen in Äquatornähe,[119] die möglicherweise eisfrei blieben.[121] Zum Zeitpunkt des Einsetzens der Sturtischen Eiszeit war der atmosphärische Sauerstoffgehalt nämlich schon auf etwa 1 % des heutigen Werts gestiegen[122] und überall dort, wo die Luft mit dem Meerwasser in Verbindung trat, hätte sich Sauerstoffgas in den Wassern lösen können.
Weiterhin aber verwitterten die Gesteine von jenen Vulkanen und Gebirgen, die das Eis durchstießen. Es entstanden Stäube, die von Winden erfasst und auf den Oberseiten der Gletscher abgelagert wurden. Solche mineralischen Stäube waren reich an Nährsalzen. Die Salze wurden in Flüssigwasser gelöst, wenn sich im Sommer flache Schmelzwasserseen auf den Gletschern bildeten. Wahrscheinlich gediehen vor allem Cyanobakterien in diesen flachen und nährsalzreichen Gewässern. Die Bakterien betrieben oxygene Photosynthese, wenn genügend Sonnenlicht durch die staubreiche Luft zu ihnen drang.[123] Die oxygene Photosynthese reicherte die erdnahe Luft weiter mit Sauerstoffgas an,[124] so dass gegen Ende der Sturtischen Eiszeit die Luftsauerstoff-Konzentration möglicherweise etwas mehr als ein Hundertstel ihres heutigen Werts betrug.[125] Ein Anteil des Sauerstoffs gelangte auch unter das Eis ins Meer. Die Stellen, an denen sich Schelfeis vom Meeresboden abhebt und auf dem Wasser zu schwimmen beginnt, heißen Aufsetzlinien. Auch während der Eiszeiten des Cryogeniums traten an den Aufsetzlinien wahrscheinlich subglaziale Schmelzwässer aus. In ihnen befand sich etwas Sauerstoff. Der Sauerstoff stammte aus Luftblasen, die vormals im Gletschereis eingeschlossen worden waren und nun in den Schmelzwässern gelöst wurden. Die subglazialen Schmelzwässer vermischten sich an den Aufsetzlinien mit dem Meerwasser. Somit wurde es mit Sauerstoff angereichert. Mit Hilfe dieser Schmelzwasser-Sauerstoff-Pumpe entstanden unter dem schwimmenden Eis vor den Aufsetzlinien leicht oxygenierte Wasserkörper. Auf Streifen von wenigen hundert Metern Breite hätten sich Schwämme und andere benthische aerobe Organismen ansiedeln können. Jenseits davon griffen oxygenierte Wasserschwaden hinaus, die sich zunehmend in Richtung Eisdeckenunterseite verjüngten, bis sie ungefähr zweitausend Meter vor den Aufsetzlinien endeten. In diesen Wasserschwaden hätten pelagische aerobe Lebensformen überleben können.[126]
Die Umwelt des Cryogeniums wirkte mit kräftig ausgeprägten abiotischen Selektionsfaktoren auf die Schwämme. Ein gewisser Teil der damals evolvierten Überlebensfähigkeit könnte bis heute weiter vererbt worden sein. Rezent bilden die Dauerstadien (Gemmulae) des Süßwasserschwamms Ephydatia muelleri selbst dann neue Schwammkörper, wenn sie 112 Tage unter anoxischen Bedingungen aufbewahrt worden sind.[127] Der kriechende Meeresschwamm Tethya wilhelma vollführt seine regelmäßigen Ganzkörper-Kontraktionen mit üblichen Wiederholungsraten bei 4 % der heutigen atmosphären Sauerstoffkonzentration.[128] Auch bei 0,25 % ändert er noch nicht die Ableseraten seiner Gene.[129] Weiterhin überstehen mehr als 80 % der Gemmulae des Süßwasserschwamms Eunapius fragilis eine einstündige Abkühlung auf −70 °C.[130] Darüber hinaus wurde im Jahr 2016 auf dem antarktischen Filchner-Ronne-Schelfeis ein Loch durch 872 dickes Eis gebohrt. An der Bohrstelle ragte die Oberseite des Schelfeises 111 Meter über den Meeresspiegel. Mit Hilfe einer Tauchkamera wurden die darunter liegenden 472 Meter freier Wassersäule überwunden und der Meeresgrund erreicht. Dort wuchsen an den Seiten eines Felsblocks ein gestielter Schwamm und fünfzehn ungestielte Schwämme, alle von jeweils einigen Zentimetern Größe. Die Schwämme lebten in völliger Dunkelheit in einer Meerestiefe von insgesamt 1.233 Metern (1.344 Meter unter der Schelfeisoberfläche) sowie in einer Entfernung von 260 Kilometern vom Schelfeisrand und bei einer Wassertemperatur von −2,2 Grad Celsius.[131]
Steroid-Biomarker
Die ältesten chemischen Fossilien von Schwämmen könnten aus einem jüngeren Abschnitt des Cryogeniums stammen. Sie könnten in zwei Biomarkern aus der Gruppe der Steroide gesehen werden, die 24-Isopropylcholestan und 26-Methylstigmastan heißen. Die Moleküle wurden in Gesteinen und Erdöl aus Oman gefunden. Heute werden sie ausschließlich von Schwämmen produziert. Die Biomarker könnten darauf hindeuten, dass Schwämme vor mindestens 635 Millionen Jahren tatsächlich existierten.[132][133] Jedoch könnten die Stoffe auch von anderen Organismen herrühren. Einzeller aus der Gruppe der Rhizarien stellen Vorgänger beider Moleküle her,[134] gleiches gilt für Grünalgen. Die Vorgängermoleküle hätten anschließend durch geochemische Prozesse verändert werden können, so dass sie heute als 24-Isopropylcholestan und 26-Methylstigmastan vorliegen.[135][136]
Ediacarium
Wahrscheinlich ragten während des gesamten Cryogeniums Vulkane durch die Eisdecken. Sie reicherten die Erdatmosphäre über mehrere Jahrmillionen allmählich mit Kohlendioxid an. Das Gas erreichte das Mehrhundertfache seiner heutigen atmosphärischen Konzentration und steigerte den natürlichen Treibhauseffekt beträchtlich. Auf diese Weise wurden schließlich die Vereisungen beendet. Die Erde ging in eine ausgeprägte Warmphase über. Das Eis schmolz, der erdweite Meeresspiegel stieg um bis zu 500 Meter.[137] Es begann die Erdzeitperiode des Ediacariums.
Weng'an Biota
Die sehr feinkörnigen Phosphoriten der Doushantuo-Formation (Südwest-China) enthalten die Weng'an Biota. Die Mikrofossilien besitzen wahrscheinlich ein Alter von etwas mehr als 609 Millionen Jahren[138] und wurden als Eier oder frühe Embryonen von Tieren interpretiert. Allerdings könnten sie genauso Überreste von Algenzysten darstellen[139] oder auch von sehr großen Schwefelbakterien stammen, die der rezenten Gattung Thiomargarita ähnelten.[140] Dennoch scheinen zumindest die Weng'an-Biota-Fossilien der Gattungen Tianzhushania,[141] Spiralicellula und Megasphaera größere Ähnlichkeiten mit frühen Tierembryonen zu besitzen.[142] Die Kriterien, mit denen die drei Gattungen zu Tierembryonen erklärt worden waren, wurden trotzdem als nicht stichhaltig zurückgewiesen.[143] Andererseits scheinen bei Megasphaera sogar mehrere Stadien unterscheidbar zu sein, die an Vorgänge während der frühen embryonalen Entwicklung von Tieren erinnern.[144][145]
Eocyathispongia
Aus den Gesteinen der Doushantuo-Formation könnten weitere Spuren früher Schwämme geborgen worden sein. Dort wurde in 600 Millionen Jahre alten marinen Flachwasser-Sedimentgesteinen ein einziges und winziges Exemplar der Gattung Eocyathispongia gefunden. Das Fossil besitzt ein Volumen von etwa drei Kubikmillimetern und zeigt eine knotenhaft-kugelförmige Gestalt. Sein Inneres besteht aus drei Kammern, die jeweils durch eine Öffnung mit dem umgebenden Wasser verbunden waren. Die Öffnungen wurden als Oscula gedeutet. Eocyathispongia bestand aus hunderttausenden Zellen. Die Wände der drei Kammern waren aus mehreren Zellschichten aufgebaut.[146] Im Inneren des Fossils wurden Felder aus hunderten dicht aneinandergereihter, winziger topfartiger Waben entdeckt. Dort könnten möglicherweise Choanocyten aufgereiht gewesen sein. Von diesen Zellen fehlt ansonsten aber jede Spur.[147] Die Schwamm-Zugehörigkeit des Fossils kann auf mehreren Wegen bezweifelt werden. Das Fossil besitzt weder Ostia noch Schwammspicula. Es ähnelt auch in seiner äußeren Gestalt keinem sonst bekannten Schwamm.[148] Außerdem könnten die inneren Oberflächen von Eocyathispongia zu klein für die Ernährung des Gesamtorganismus gewesen sein. Die dort vermeintlich sitzenden Choanocyten hätten vielleicht nicht genügend Nahrungspartikel abfiltrieren können, um sämtliche Zellen des Körpers ausreichend zu versorgen.[149]
Schwammspicula
Darüber hinaus könnten in der Doushantuo-Formation noch fossile Schwammspicula liegen. Das Alter ihres Fundorts wird auf 580 Millionen Jahre geschätzt.[150] Auch hier ist umstritten, ob es sich wirklich um Überreste von Schwämmen handelt.[151] Die fossilen Partikel könnten ebenso fossile Fragmente von Strahlentierchen (Radiolaria) darstellen.[16] Möglicherweise haben die verschiedenen Linien der Schwämme erst vierzig Millionen Jahre später und unabhängig voneinander begonnen, härtende Biomineralisationen ihrer Spicula zu evolvieren.[152][153]
Tabulata
Alles in allem scheint noch kein allgemein überzeugendes Schwamm-Fossil aus Tonium, Cryogenium oder Ediacarium entdeckt worden zu sein.[154] Gemäß der molekularen Uhr könnten andererseits schon vor etwa 920 Millionen Jahren[14] aus der Stammgruppe der Schwämme die übrigen Tiere hervorgegangen sein.[155][156][63] Vielleicht besaß der letzte gemeinsame Vorfahre aller übrigen Tiere ein scheibenförmiges Aussehen („Placula“)[157] oder er ähnelte einer Hohlkugel („Gastraea“).[158][159] In beiden Fällen soll dieser winzige Organismus aus zwei Zellschichten bestanden haben. Zur Weng'an Biota gehören auch eine Reihe feiner fossiler Röhren, die als Spuren einer Gruppe der übrigen Tiere gedeutet wurden. Sie sollten von Nesseltieren aus der Klasse der Blumentiere (Anthozoa) herrühren, genauer gesagt aus der ausgestorbenen Gruppe der Tabulata.[160] Jedoch könnten die Röhren ebenso zum Beispiel von Algenfäden hinterlassen worden sein.[161]
Dickinsonia
Südaustralische Gesteine mit einem Alter zwischen 571 bis 539 Millionen Jahren enthalten Abdrücke einer winzigen und gedrungen wurmförmigen Lebensform, die möglicherweise zu den Tieren gehörte, genauer gesagt zu den Zweiseitentieren (Bilateria). Sie erhielt den Gattungsnamen Ikaria.[162] Aus dem gleichen zeitlichen Horizont stammen die vermutlichen Zweiseitentiere Spriggina[163][164] und Kimberella[165] mit etwa 555 Millionen Jahren,[166] sowie die mögliche Stammgruppen-Rippenqualle (Ctenophora) Eoandromeda mit 551 Millionen Jahren.[167] Ähnliche Alter besitzen der wahrscheinlich röhrenbewohnende Wurm Cloudina[168] und der segmentierte Wurm Yilingia.[169] Dazu tritt noch ein mögliches Lophotrochozoon namens Namacalathus aus 547 Millionen Jahre alten namibischen Gesteinen.[170] Auch andere Vertreter dieser sogenannten Ediacara-Fauna wurden verschiedentlich als Tiere vorgeschlagen, wie zum Beispiel die Gattung Dickinsonia.[15] Dass letztere ein Tier war, könnte durch bestimmte Steroide belegt worden sein. Die Moleküle wurden im Fossil gefunden und gelten in der Regel als Biomarker für Tiere.[109][171] Möglicherweise stellte Dickinsonia eine Gattung besonders großer Plattentiere (Placozoa) dar.[172]
Kambrium
Das Ediacarium neigte sich dem Ende entgegen. Auf der Südhalbkugel verbanden sich Landmassen zum Großkontinent Gondwana. Dabei brachen viele Vulkane aus. Sie reicherten den Erdatmosphäre mit dem Treibhausgas Kohlendioxid an. Die globale Durchschnittstemperatur stieg.[173] Die Ozeane durchliefen eine Phase großer Sauerstoffarmut.[174] Doch unter den wärmeren Bedingungen beschleunigte sich die Verwitterung der Gesteine. Ihre Minerale wurden von Gewässern gelöst und gelangten ins Meer. Dort wirkten sie als Dünger des Algenwachstums. Die somit vermehrte oxygene Photosynthese ließ den Sauerstoffgehalt steigen.[173] Dann wechselte die Erde in die Erdzeitperiode des Kambriums vor 541 Millionen Jahren. Vermutlich erwies sich der erhöhte Sauerstoffgehalt als einer der Hauptgründe für die nun einsetzende kambrische Explosion.[175] Die Tiere bildeten fortan Hartsubstanzen in ihren Stützgeweben und für Schalen und Gehäuse. Dadurch begünstigten sie ihre Fossilisation. Deshalb sind Fossilien der Choanozoa seit dem Kambrium in großer Menge und Vielfalt vorhanden.[176] Auch die ersten unbestrittenen Schwammspicula lagerten sich während des Übergangs zum Kambrium ab.[153]
Einzelnachweise
- ↑ 1,0 1,1 1,2 Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 125.
- ↑ Jean Vacelet, NicoleBoury-Esnault: Carnivorous sponges. In: Nature. Band 373, 1995, doi:10.1016/j.ympev.2015.08.022, S. 333.
- ↑ Henry M. Reiswig: Bacteria as food for temperate-water marine sponges. In: Canadian Journal of Zoology. Band 53, 1975, doi:10.1139/z75-072, S. 582.
- ↑ Gonzalo Giribet, Gregory D. Edgecombe: The Invertebrate Tree of Life. Princeton University Press, Princeton/Oxford 2020, ISBN 978-0691170251, S. 38.
- ↑ Manuel Maldonado: Choanoflagellates, choanocytes, and animal multicellularity. In: Invertebrate Biology. Band 123, 2004, doi:10.1111/j.1744-7410.2004.tb00138.x, S. 1.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 2, 4.
- ↑ Mark J.Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 73.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 44, 230.
- ↑ 9,0 9,1 Stephen R. Fairclough, Mark J. Dayel, Nicole King: Multicellular development in a choanoflagellate. In: Current Biology. Band 20, 2010, doi:10.1016/j.cub.2010.09.014, S. R875.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 44.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 18.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 239.
- ↑ Julia M. Brown, Jessica M. Labonté, Joseph Brown, Nicholas R. Record, Nicole J. Poulton, Michael E. Sieracki, Ramiro Logares, Ramunas Stepanauskas: Single Cell Genomics Reveals Viruses Consumed by Marine Protists. In: Frontiers in Microbiology. Band 11, 2020, Artikel Nr. 524828, doi:10.3389/fmicb.2020.524828, S. 8–9.
- ↑ 14,0 14,1 14,2 14,3 14,4 Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, Artikel Nr. 3599, doi:10.1038/s41598-017-03791-w, S. 3–4.
- ↑ 15,0 15,1 15,2 Graham E. Budd, and Sören Jensen: The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution. In: Biological Reviews. Band 92, 2017, doi:10.1111/brv.12239, S. 452.
- ↑ 16,0 16,1 Joseph P. Botting, Lucy A. Muir: Early sponge evolution: A review and phylogenetic framework. In: Palaeoworld. Band 27, 2018, doi:10.1016/j.palwor.2017.07.001, S. 1.
- ↑ John Ellis: On the nature and formation of sponges. In: Philosophical Transactions of the Royal Society of London. Band 55, 1765, doi:10.1098/rstl.1765.0032, S. 283–284.
- ↑ 18,0 18,1 Libbie Henrietta Hyman: The Invertebrates: Protozoa through Ctenophora. McGraw-Hill Book Company, New York/London 1940, ISBN 9780070316607, S. 284.
- ↑ Christian Gottfried Ehrenberg: Über die Entwicklung und Lebensdauer der Infusorien. In: Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin. Aus dem Jahre 1831. Berlin 1832, S. 95 (Digitalisat).
- ↑ Raoul Heinrich Francé: Der Organismus der Craspedomonaden. Budapest 1897, S. 118 (Digitalisat).
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 1.
- ↑ Georg Fresenius: Beiträge zur Kenntniss mikroskopischer Organismen. In: Abhandlungen der Senckenbergischen naturforschenden Gesellschaft. Band 2, 1858, S. 233, 242, Tafel X (Digitalisat).
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 2.
- ↑ Raoul Heinrich Francé: Der Organismus der Craspedomonaden. Budapest 1897, S. 121 (Digitalisat).
- ↑ Félix Dujardin: Histoire naturelle des zoophytes. Librairie encyclopédique de Roret, Paris 1841, S. 306 (Digitalisat).
- ↑ Henry James-Clark: On the Spongiae Ciliatae as Infusoria Flagellata. In: Memoirs read before the Boston Society of Natural History. Band 1, 1867, S. 305–340 (Digitalisat).
- ↑ Thomas Henry Huxley: On the Classification of the Animal Kingdom. In: The American Naturalist. Band 09, 1875, S. 67 (Digitalisat).
- ↑ vgl. Gert Wörheide, Martin Dohrmann, Dirk Erpenbeck, Claire Larroux, Manuel Maldonado, Oliver Voigt, Carole Borchiellini, Dennis V. Lavrov: Deep Phylogeny and Evolution of Sponges (Phylum Porifera) . In: Advances in Marine Biology. Band 61, 2012, doi:10.1016/B978-0-12-387787-1.00007-6, S. 1.
- ↑ 29,0 29,1 Patricia O. Wainright, Gregory Hinkle, Mitchell L. Sogin, Shawn K. Stickel: Monophyletic origins of the Metazoa: An evolutionary link with fungi. In: Science. Band 260, 1993, doi:10.1126/science.8469985, S. 340.
- ↑ 30,0 30,1 Thomas Cavalier-Smith, Ema E-Y. Chao: Phylogeny of choanozoa, apusozoa, and other protozoa and early eukaryote megaevolution. In: Journal of Molecular Evolution. Band 56, 2003, doi:10.1007/s00239-002-2424-z, S. 540.
- ↑ 31,0 31,1 Emma Steenkamp, Jane Wright, Sandra Baldauf: The Protistan Origins of Animals and Fungi. In: Molecular Biology and Evolution. Band 23, 2006, doi:10.1093/molbev/msj011, S. 99.
- ↑ Jean-Luc Da Lage, Etienne G. J. Danchin, Didier Casane: Where do animal α-amylases come from? An interkingdom trip. In: Federation of European Biochemical Societies Letters. Band 581, 2007, doi:10.1016/j.febslet.2007.07.019, S. 3931–3932.
- ↑ Ulrich Kutschera: Evolutionsbiologie. Verlag Eugen Ulmer, Stuttgart 2015, ISBN 978-3825286231, S. 185.
- ↑ Stephen R. Fairclough, Zehua Chen, Eric Kramer, Qiandong Zeng, Sarah Young, Hugh M. Robertson, Emina Begovic, Daniel J. Richter, Carsten Russ, M. Jody Westbrook, Gerard Manning, B. Franz Lang, Brian J. Haas, Chad Nusbaum, Nicole King: Premetazoan genome evolution and the regulation of cell differentiation in the choanoflagellate Salpingoeca rosetta. In: Genome Biology. Band 14, 2013, R 15, doi:10.1186/gb-2013-14-2-r15, S. 4.
- ↑ Graham E. Budd, and Sören Jensen: The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution. In: Biological Reviews. Band 92, 2017, doi:10.1111/brv.12239, S. 448.
- ↑ 36,0 36,1 Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 127.
- ↑ Hervé Philippe, Romain Derelle, Philippe Lopez, Kerstin Pick, Carole Borchiellini, Nicole Boury-Esnault, Jean Vacelet, Emmanuelle Renard, Evelyn Houliston, Eric Quéinnec, Corinne Da Silva, Patrick Wincker, Hervé Le Guyader, Sally Leys, Daniel J. Jackson, Fabian Schreiber, Dirk Erpenbeck, Burkhard Morgenstern, Gert Wörheide, Michael Manuel: Phylogenomics Revives Traditional Views on Deep Animal Relationships. In: Current Biology. Band 19, 2009, doi:10.1016/j.cub.2009.02.052, S. 709.
- ↑ Thomas Cavalier-Smith: Kingdom Protozoa and Its 18 Phyla. In: Microbiological Reviews. Band 57, 1993, doi:10.1128/MMBR.57.4.953-994.1993, S. 971.
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 2.
- ↑ Sina M. Adl, David Bass, Christopher E. Lane, Julius Lukes, Conrad L. Schoch, Alexey Smirnov, Sabine Agatha, Cedric Berney, Matthew W. Brown, Fabien Burki, Paco Cárdenas, Ivan Cepicka, Lyudmila Chistyakova, Javier del Campo, Micah Dunthorn, Bente Edvardsen, Yana Eglit, Laure Guillou, Vladimír Hampl, Aaron A. Heiss, Mona Hoppenrath, Timothy Y. James, Anna Karnkowska, Sergey Karpov, Eunsoo Kim, Martin Kolisko, Alexander Kudryavtsev, Daniel J.G. Lahr, Enrique Lara, Line Le Gall, Denis H. Lynn, David G. Mann, Ramon Massana, Edward A.D. Mitchell, Christine Morrow, Jong Soo Park, Jan W. Pawlowski, Martha J. Powell, Daniel J. Richter, Sonja Rueckert, Lora Shadwick, Satoshi Shimano, Frederick W. Spiegel, Guifré Torruella, Noha Youssef, Vasily Zlatogursky, Qianqian Zhang: Revisions to the Classification, Nomenclature, and Diversity of Eukaryotes. In: Journal of Eukaryotic Microbiology. Band 66, 2019, doi:10.1111/jeu.12691, S. 20.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 10.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press 2015, ISBN 978-0521884440, S. 25, 28.
- ↑ Sally P. Leys, Dafne I. Eerkes-Medrano: Feeding in a Calcareous Sponge: Particle Uptake by Pseudopodia. In: Biology Bulletin. Band 211, 2006, S. 157.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/Berlin 2006, ISBN 3827371805, S. 769.
- ↑ Gonzalo Giribet, Gregory D. Edgecombe: The Invertebrate Tree of Life. Princeton University Press, Princeton/Oxford 2020, ISBN 978-0691170251, S. 36–37.
- ↑ 46,0 46,1 46,2 46,3 46,4 46,5 46,6 46,7 Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, S. 2.
- ↑ Jasmine L. Mah, Karen K. Christensen-Dalsgaard, Sally P. Leys: Choanoflagellate and choanocyte collar-flagellar systems and the assumption of homology. In: Evolution & Development. Band 16, 2014, doi:10.1111/ede.12060, S. 25.
- ↑ Peter Ax: Das System der Metazoa I. Ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, Stuttgart/Jena/New York 1995, ISBN 3-437-30803-3, S. 58–59.
- ↑ 49,0 49,1 Casey W. Dunn, Sally P. Leys, Steven H.D. Haddock: The hidden biology of sponges and ctenophores. In: Trends in Ecology & Evolution. Band 30, 2015, doi:10.1016/j.tree.2015.03.003, S. 287.
- ↑ Denis V. Tikhonenkov, Kirill V. Mikhailov, Elisabeth Hehenberger, Sergei A. Karpov, Kristina I. Prokina, Anton S. Esaulov, Olga I. Belyakova, Yuri A. Mazei, Alexander P. Mylnikov, Vladimir V. Aleoshin, Patrick J. Keeling: New Lineage of Microbial Predators Adds Complexity to Reconstructing the Evolutionary Origin of Animals. In: Current Biology. Band 30, 2020, doi:10.2139/ssrn.3606769, S. 4504 (S. 5).
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 5.
- ↑ Guifré Torruella, Romain Derelle, Jordi Paps, B. Franz Lang, Andrew J. Roger, Kamran Shalchian-Tabrizi, Iñaki Ruiz-Trillo: Phylogenetic Relationships within the Opisthokonta Based on Phylogenomic Analyses of Conserved Single-Copy Protein Domains. In: Molecular Biology and Evolution. Band 29, 2011, doi:10.1093/molbev/msr185, S. 536.
- ↑ Salma Sana, Emilie A. Hardouin, Richard Paley, Tiantian Zhang, Demetra Andreou: The complete mitochondrial genome of a parasite at the animal-fungal boundary. In: Parasites & Vectors. Band 13, 2020, Artikel-Nr. 81, doi:10.1186/s13071-020-3926-5, S. 2.
- ↑ Thomas Cavalier-Smith, M.T.E. Paula Allsopp: Corallochytrium, an enigmatic non-flagellate protozoan related to choanoflagellates. In: European Journal of Protistology. Band 32, 1996, doi:10.1016/S0932-4739(96)80053-8, S. 306.
- ↑ Elisabeth Hehenberger, Denis V. Tikhonenkov, Martin Kolisko, Javier del Campo, Anton S. Esaulov, Alexander P. Mylnikov, Patrick J. Keeling: Novel Predators Reshape Holozoan Phylogeny and Reveal the Presence of a Two-Component Signaling System in the Ancestor of Animals. In: Current Biology. Band 27, 2017, doi:10.1016/j.cub.2017.06.006, S. 2043, e2.
- ↑ Elisabeth Hehenberger, Denis V. Tikhonenkov, Martin Kolisko, Javier del Campo, Anton S. Esaulov, Alexander P. Mylnikov, Patrick J. Keeling: Novel Predators Reshape Holozoan Phylogeny and Reveal the Presence of a Two-Component Signaling System in the Ancestor of Animals. In: Current Biology. Band 27, 2017, doi:10.1016/j.cub.2017.06.006, S. 2045.
- ↑ Frank Nitsche, Martin Carr, Hartmut Arndt, Barry S.C. Leadbeater: Higher Level Taxonomy and Molecular Phylogenetics of the Choanoflagellatea. In: Journal of Eukaryotic Microbiology. Band 58, 2011, doi:10.1111/j.1550-7408.2011.00572.x, S. 452.
- ↑ Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, Artikel Nr. 3599, doi:10.1038/s41598-017-03791-w, S. 4.
- ↑ Martin Carr, Daniel J. Richter, Parinaz Fozouni, Timothy J. Smith, Alexandra Jeuck, Barry S.C. Leadbeater, Frank Nitsche: A six-gene phylogeny provides new insights into choanoflagellate evolution. In: Molecular Phylogenetics and Evolution. Band 107, 2017, doi:10.1016/j.ympev.2016.10.011, S. 166–167, 172.
- ↑ Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, S. 1.
- ↑ Peter Sitte: Morphologie. In: Peter Sitte, Hubert Ziegler, Friedrich Ehrendorfer, Andreas Bresinsky: Strasbuger • Lehrbuch der Botanik. Gustav Fischer Verlag, 34. Auflage, Stuttgart/Jena/Lübeck/Ulm 1998, ISBN 978-3437255007, S. 207–209.
- ↑ 62,0 62,1 Daniel J. Richter, Nicole King: The Genomic and Cellular Foundations of Animal Origins. In: Annual Review of Genetics. Band 47, 2013, doi:10.1146/annurev-genet-111212-133456, S. 509–510.
- ↑ 63,0 63,1 63,2 Paschalia Kapli, Maximilian J. Telford: Topology-dependent asymmetry in systematic errors affects phylogenetic placement of Ctenophora and Xenacoelomorpha. In: Science Advances. Band 6, 2020, Artikel eabc5162, doi:10.1126/sciadv.abc5162, S. 7.
- ↑ Volker Storch, Ulrich Welsch: Kükenthal • Zoologisches Praktikum. Springer Spektrum Verlag, 27. Auflage, Berlin/Heidelberg 2014, ISBN 978-3642419362, S. 466: „Der verbreiteten Auffassung, dass Schwämme keine echten Gewebe bilden, wird auch widersprochen; desungeachtet nehmen die Schwämme auch auf histologischer Ebene eine isolierte, einzigartige Stellung ein.“
- ↑ Martin Dohrmann, Gert Wörheide: Novel Scenarios of Early Animal Evolution—Is It Time to Rewrite Textbooks?. In: Integrative and Comparative Biology. Band 53, 2013, S. 504.
- ↑ Richard K. Grosberg, Richard R. Strathmann: The Evolution of Multicellularity: A Minor Major Transition? In: Annual Review of Ecology, Evolution, and Systematics. Band 38, 2007, doi:10.1146/annurev.ecolsys.36.102403.114735, S. 623.
- ↑ 67,0 67,1 67,2 67,3 Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, S. 5.
- ↑ 68,0 68,1 Claus Nielsen: Six major steps in animal evolution: are we derived sponge larvae?. In: Evolution & Development. Band 10, 2008, doi:10.1111/j.1525-142X.2008.00231.x, S. 243–246.
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 4–5.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2013–2014.
- ↑ Miguel A. Naranjo-Ortiz, Toni Gabaldón: Fungal evolution: diversity, taxonomy and phylogeny of the Fungi. In: Biological Reviews. Band 94, 2019, doi:10.1111/brv.12550, S. 2107.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2017.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2013, 2020.
- ↑ Ming Tang, Xu Chu, Jihua Hao, Bing Shen: Orogenic quiescence in Earth’s middle age. In: Science. Band 371, 2021, doi:10.1126/science.abf1876, S. 729.
- ↑ 76,0 76,1 76,2 Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13046.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13047, 13049–13050.
- ↑ Paul K. Strother, Martin D. Brasier, David Wacey, Leslie Timpe, Martin Saunders, Charles H. Wellman: A possible billion-year-old holozoan with differentiated multicellularity. In: Current Biology. Band 31, 2021, doi:10.1016/j.cub.2021.03.051, S. 2658–2665.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13049.
- ↑ 80,0 80,1 Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13050.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13048.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13046–13049.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 14.
- ↑ Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 130.
- ↑ Dale Kaiser: Building a multicellular organism. In: Annual Review of Genetics. Band 35, 2001, doi:10.1146/annurev.genet.35.102401.090145, S. 117, 120.
- ↑ Richard K. Grosberg, Richard R. Strathmann: The Evolution of Multicellularity: A Minor Major Transition? In: Annual Review of Ecology, Evolution, and Systematics. Band 38, 2007, doi:10.1146/annurev.ecolsys.36.102403.114735, S. 628.
- ↑ Matthew D. Herron, Joshua M. Borin, Jacob C. Boswell, Jillian Walker, I-Chen Kimberly Chen, Charles A. Knox, Margrethe Boyd, Frank Rosenzweig, William C. Ratcliff: De novo origins of multicellularity in response to predation. In: Scientific Reports. Band 9, 2019, doi:10.1038/s41598-019-39558-8, Artikel Nr. 2328.
- ↑ Joana P. Bernardes, Uwe John, Noemi Woltermann, Martha Valiadi, Ruben J. Hermann, Lutz Becks: The evolution of convex trade-offs enables the transition towards multicellularity. In: Nature Communications. Band 12, 2021, Artikel Nr. 4222, doi:10.1038/s41467-021-24503-z, S. 6.
- ↑ Joana P. Bernardes, Uwe John, Noemi Woltermann, Martha Valiadi, Ruben J. Hermann, Lutz Becks: The evolution of convex trade-offs enables the transition towards multicellularity. In: Nature Communications. Band 12, 2021, Artikel Nr. 4222, doi:10.1038/s41467-021-24503-z, S. 2.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 13–14.
- ↑ 91,0 91,1 Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 76.
- ↑ Hoa Nguyen, Mimi A.R. Koehl, Christian Oakes, Greg Bustamante, Lisa Fauci: Effects of cell morphology and attachment to a surface on the hydrodynamic performance of unicellular choanoflagellates. In: Journal of the Royal Society Interface. Band 16, 2019, Artikel Nr. 20180736, doi:10.1098/rsif.2018.0736, S. 1.
- ↑ Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 75.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 7, 10.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 5, 6.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 6.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 2.
- ↑ 98,0 98,1 Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 3.
- ↑ 99,0 99,1 Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 1.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 3–5.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 9.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 10.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 519, 521–522.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 521.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 519, 522.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 522.
- ↑ John A. Cunningham, Alexander G. Liu, Stefan Bengtson, Philip C. J. Donoghue: The origin of animals: Can molecular clocks and the fossil record be reconciled? In: BioEssays. Band 39, 2016, doi:10.1002/bies.201600120, S. 1.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 972 (S. 1).
- ↑ 109,0 109,1 Ilya Bobrovskiy, Janet M. Hope, Andrey Ivantsov, Benjamin J. Nettersheim, Christian Hallmann, Jochen J. Brocks: Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. In: Science, Band 361, 2018, doi:10.1126/science.aat7228, S. 1246–1249.
- ↑ Qing Tang, Bin Wan, Xunlai Yuan, A.D. Muscente, Shuhai Xiao: Spiculogenesis and biomineralization in early sponge animals. In: Nature Communications. Band 10, 2019, Artikel Nr. 3348, doi:10.1038/s41467-019-11297-4, S. 9.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1457.
- ↑ Elizabeth C. Turner: Possible poriferan body fossils in early Neoproterozoic microbial reefs. In: Nature. Band 596, 2021, doi:10.1038/s41586-021-03773-z, S. 87–88 (1–2).
- ↑ Dirk Erpenbeck, Steve C. de Cook, Andreas Dietzel, Patricia Hendriks, Colleen Strickland, Merrick Ekins, Bernard M. Degnan, John N.A. Hooper, Gert Wörheide: Molecular und biochemical systematics of sponges (Porifera) without mineral skeleton. In: Stephan Robbert Gradstein, Simone Klatt, Felix Normann, Patrick Weigelt, Rainer Willmann, Rosemary Wilson (Hg.): Systematics 2008 • Programme and Abstracts. Universitätsverlag Göttingen, Göttingen 2008, ISBN 978-3-940344-23-6, S. 194.
- ↑ Elizabeth C. Turner: Possible poriferan body fossils in early Neoproterozoic microbial reefs. In: Nature. Band 596, 2021, doi:10.1038/s41586-021-03773-z, S. 90 (4).
- ↑ Charles Kimberlin 'Bob' Brain, Anthony R. Prave, Karl-Heinz Hoffmann, Anthony E. Fallick, Andre Botha, Donald A. Herd, Craig Sturrock, Iain Young, Daniel J. Condon, Stuart G. Allison: The first animals: ca. 760-million-year-old sponge-like fossils from Namibia. In: South African Journal of Science. Band 108, 2012, Artikel Nr. 658, doi:10.4102/sajs.v108i1/2.658, S. 3, 5.
- ↑ 116,0 116,1 Charles Kimberlin 'Bob' Brain, Anthony R. Prave, Karl-Heinz Hoffmann, Anthony E. Fallick, Andre Botha, Donald A. Herd, Craig Sturrock, Iain Young, Daniel J. Condon, Stuart G. Allison: The first animals: ca. 760-million-year-old sponge-like fossils from Namibia. In: South African Journal of Science. Band 108, 2012, Artikel Nr. 658, doi:10.4102/sajs.v108i1/2.658, S. 7.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 982 (S. 11).
- ↑ Scott MacLennan, Yuem Park, Nicholas Swanson-Hysell, Adam Maloof, Blair Schoene, Mulubrhan Gebreslassie, Eliel Antilla, Tadele Tesema, Mulugeta Alene, Bereket Haileab: The arc of the Snowball: U-Pb dates constrain the Islay anomaly and the initiation of the Sturtian glaciation. In: Geology. Band 46, 2018, doi:10.1130/G40171.1, S. 3–4.
- ↑ 119,0 119,1 119,2 Maxwell A. Lechte, Malcolm W. Wallace, Ashleigh van Smeerdijk Hood, Weiqiang Li, Ganqing Jiang, Galen P. Halverson, Dan Asael, Stephanie L. McColl, Noah J. Planavsky: Subglacial meltwater supported aerobic marine habitats during Snowball Earth. In: PNAS. Band 116, 2019, doi:10.1073/pnas.1909165116, S. 25478.
- ↑ Erik A. Sperling, Charles J. Wolock, Alex S. Morgan, Benjamin C. Gill, Marcus Kunzmann, Galen P. Halverson, Francis A. Macdonald, Andrew H. Knoll, David T. Johnston: Statistical analysis of iron geochemical data suggests limited late Proterozoic oxygenation. In: Nature. Band 523, 2015, doi:10.1038/nature14589, S. 451.
- ↑ Philip A. Allen, James L. Etienne: Sedimentary challenge to Snowball Earth. In: Nature Geoscience. Band 1, 2008, doi:10.1038/ngeo355, S. 824.
- ↑ Wei Wei, Robert Frei, Robert Klaebe, Da Li, Guang-Yi Wei, Hong-Fei Ling: Redox condition in the Nanhua Basin during the waning of the Sturtian glaciation: A chromium-isotope perspective. In: Precambrian Research. Band 319, 2018, doi:10.1016/j.precamres.2018.02.009, S. 1, 10.
- ↑ Paul F. Hoffman, Dorian S. Abbot, Yosef Ashkenazy, Douglas I. Benn, Jochen J. Brocks, Phoebe A. Cohen, Grant M. Cox, Jessica R. Creveling, Yannick Donnadieu, Douglas H. Erwin, Ian J. Fairchild, David Ferreira, Jason C. Goodman, Galen P. Halverson, Malte F. Jansen, Guillaume Le Hir, Gordon D. Love, Francis A. Macdonald, Adam C. Maloof, Camille A. Partin, Gilles Ramstein, Brian E. J. Rose, Catherine V. Rose, Peter M. Sadler, Eli Tziperman, Aiko Voigt, Stephen G. Warren: Snowball Earth climate dynamics and Cryogenian geology-geobiology. In: Science Advances. Band 3, 2017, Artikel Nr. e1600983, doi:10.1126/sciadv.1600983, S. 14–16.
- ↑ Paul F. Hoffman, Dorian S. Abbot, Yosef Ashkenazy, Douglas I. Benn, Jochen J. Brocks, Phoebe A. Cohen, Grant M. Cox, Jessica R. Creveling, Yannick Donnadieu, Douglas H. Erwin, Ian J. Fairchild, David Ferreira, Jason C. Goodman, Galen P. Halverson, Malte F. Jansen, Guillaume Le Hir, Gordon D. Love, Francis A. Macdonald, Adam C. Maloof, Camille A. Partin, Gilles Ramstein, Brian E. J. Rose, Catherine V. Rose, Peter M. Sadler, Eli Tziperman, Aiko Voigt, Stephen G. Warren: Snowball Earth climate dynamics and Cryogenian geology-geobiology. In: Science Advances. Band 3, 2017, Artikel Nr. e1600983, doi:10.1126/sciadv.1600983, S. 20–21.
- ↑ Wei Wei, Robert Frei, Robert Klaebe, Da Li, Guang-Yi Wei, Hong-Fei Ling: Redox condition in the Nanhua Basin during the waning of the Sturtian glaciation: A chromium-isotope perspective. In: Precambrian Research. Band 319, 2018, doi:10.1016/j.precamres.2018.02.009, S. 10.
- ↑ Maxwell A. Lechte, Malcolm W. Wallace, Ashleigh van Smeerdijk Hood, Weiqiang Li, Ganqing Jiang, Galen P. Halverson, Dan Asael, Stephanie L. McColl, Noah J. Planavsky: Subglacial meltwater supported aerobic marine habitats during Snowball Earth. In: PNAS. Band 116, 2019, doi:10.1073/pnas.1909165116, S. 25481–25482.
- ↑ Henry M. Reiswig, Tanya L. Miller: Freshwater Sponge Gemmules Survive Months of Anoxia. In: Invertebrate Biology. Band 117, 1998, doi:10.2307/3226846, S. 1.
- ↑ Daniel B. Mills, Warren R. Francis, Sergio Vargas, Morten Larsen, Coen P.H. Elemans, Donald E. Canfield, Gert Wörheide: The last common ancestor of animals lacked the HIF pathway and respired in low-oxygen environments. In: eLife. Band 7, 2018, Artikel Nr. 31176, doi:10.7554/eLife.31176, S. 6.
- ↑ Daniel B. Mills, Warren R. Francis, Sergio Vargas, Morten Larsen, Coen P.H. Elemans, Donald E. Canfield, Gert Wörheide: The last common ancestor of animals lacked the HIF pathway and respired in low-oxygen environments. In: eLife. Band 7, 2018, Artikel Nr. 31176, doi:10.7554/eLife.31176, S. 4.
- ↑ Louis F. Ungemach, Kerry Souza, Paul E. Fell, Stephen H. Loomis: Possession and Loss of Cold Tolerance by Sponge Gemmules: A Comparative Study. In: Invertebrate Biology. Band 116, 1997, doi:10.2307/3226918, S. 1.
- ↑ Huw J. Griffiths, Paul Anker, Katrin Linse, Jamie Maxwell, Alexandra L. Post, Craig Stevens, Slawek Tulaczyk, James A. Smith: Breaking All the Rules: The First Recorded Hard Substrate Sessile Benthic Community Far Beneath an Antarctic Ice Shelf. In: Frontiers in Marine Science. Band 8, 2021, doi:10.3389/fmars.2021.642040, S. 6
- ↑ Gordon D. Love, Emmanuelle Grosjean, Charlotte Stalvies, David A. Fike, John P. Grotzinger, Alexander S. Bradley, Amy E. Kelly, Maya Bhatia, William Meredith, Colin E. Snape, Samuel A. Bowring, Daniel J. Condon, Roger E. Summons: Fossil steroids record the appearance of Demospongiae during the Cryogenian period. In: Nature. Band 457, 2009, doi:10.1038/nature07673, S. 718.
- ↑ J. Alex Zumberge, Gordon D. Love, Paco Cárdenas, Erik A. Sperling, Sunithi Gunasekera, Megan Rohrssen, Emmanuelle Grosjean, John P. Grotzinger, Roger E. Summons: Demosponge steroid biomarker 26-methylstigmastane provides evidence for Neoproterozoic animals. In: Nature Ecology & Evolution. Band 2, 2018, doi:10.1038/s41559-018-0676-2, S. 1709.
- ↑ Benjamin J. Nettersheim, Jochen J. Brocks, Arne Schwelm, Janet M. Hope, Fabrice Not, Michael Lomas, Christiane Schmidt, Ralf Schiebel, Eva C. M. Nowack, Patrick De Deckker, Jan Pawlowski, Samuel S. Bowser, Ilya Bobrovskiy, Karin Zonneveld, Michal Kucera, Marleen Stuhr, Christian Hallmann: Putative sponge biomarkers in unicellular Rhizaria question an early rise of animals. In: Nature Ecology & Evolution. Band 3, 2019, doi:10.1038/s41559-019-0806-5, S. 577.
- ↑ Ilya Bobrovskiy, Janet M. Hope, Benjamin J. Nettersheim, John K. Volkman, Christian Hallmann, Jochen J. Brocks: Algal origin of sponge sterane biomarkers negates the oldest evidence for animals in the rock record. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01334-7.
- ↑ Lennart M. van Maldegem, Benjamin J. Nettersheim, Arne Leider, Jochen J. Brocks, Pierre Adam, Philippe Schaeffer, Christian Hallmann: Geological alteration of Precambrian steroids mimics early animal signatures. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01336-5.
- ↑ Philip A. Allen, James L. Etienne: Sedimentary challenge to Snowball Earth. In: Nature Geoscience. Band 1, 2008, doi:10.1038/ngeo355, S. 817, 819, 824.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 793–794.
- ↑ Shuhai Xiao, Xunlai Yuan, Andrew H. Knoll: Eumetazoan fossils in terminal Proterozoic phosphorites? In: PNAS. Band 97, 2000, doi:10.1073/pnas.250491697, S. 13684.
- ↑ Jake V. Bailey, Samantha B. Joye, Karen M. Kalanetra, Beverly E. Flood, Frank A. Corsetti: Evidence of giant sulphur bacteria in Neoproterozoic phosphorites. In: Nature. Band 445, 2007, doi:10.1038/nature05457, S. 198.
- ↑ Shuhai Xiao, A.D. Muscente, Lei Chen, Chuanming Zhou, James D. Schiffbauer, Andrew D. Wood, Nicholas F. Polys, Xunlai Yuan: The Weng'an biota and the Ediacaran radiation of multicellular eukaryotes. In: National Science Review, Band 1, 2014, doi:10.1093/nsr/nwu061, S. 498.
- ↑ Zongjun Yin, Kelly Vargas, John Cunningham, Stefan Bengtson, Maoyan Zhu, Federica Marone, Philip Donoghue: The Early Ediacaran Caveasphaera Foreshadows the Evolutionary Origin of Animal-like Embryology. In: Current Biology. Band 29, 2019, doi:10.1016/j.cub.2019.10.057, S. 4307.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 798–799.
- ↑ Zongjun Yin, Kelly Vargas, John Cunningham, Stefan Bengtson, Maoyan Zhu, Federica Marone, Philip Donoghue: The Early Ediacaran Caveasphaera Foreshadows the Evolutionary Origin of Animal-like Embryology. In: Current Biology. Band 29, 2019, doi:10.1016/j.cub.2019.10.057, S. 4310, 4312.
- ↑ vergleiche Nagayasu Nakanishi, Shunsuke Sogab, Bernard M. Degnan: Evolutionary origin of gastrulation: insights from sponge development. In: BMC Biology. Band 12, 2014, Artikel Nr. 26, doi:10.1186/1741-7007-12-26, S. 5–6.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1454–E1455.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1457–E1458.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 799.
- ↑ Heda Agić, Anette E.S. Högström, Małgorzata Moczydłowska, Sören Jensen, Teodoro Palacios, Guido Meinhold, Jan Ove R. Ebbestad, Wendy L. Taylor, Magne Høyberget: Organically-preserved multicellular eukaryote from the early Ediacaran Nyborg Formation, Arctic Norway. In: Scientific Reports. Band 9, Artikel Nr. 14659, doi:10.1038/s41598-019-50650-x, S. 8.
- ↑ Chia-Wei Li, Jun-Yuan Chen, Tzu-En Hua: Precambrian Sponges with Cellular Structures. In: Science. Band 279, 1998, doi:10.1126/science.279.5352.879, S. 879.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 984 (S. 13).
- ↑ Qing Tang, Bin Wan, Xunlai Yuan, A.D. Muscente, Shuhai Xiao: Spiculogenesis and biomineralization in early sponge animals. In: Nature Communications. Band 10, 2019, Artikel Nr. 3348, doi:10.1038/s41467-019-11297-4, S. 2, 6–7, 9.
- ↑ 153,0 153,1 Shan Chang, Lei Zhang, Sébastien Clausen, David J.Bottjer, Qinglai Feng: The Ediacaran-Cambrian rise of siliceous sponges and development of modern oceanic ecosystems. In: Precambrian Research. Band 333, 2019, Artikel Nr. 105438, doi:10.1016/j.precamres.2019.105438, S. 1.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 995–996 (S. 24–25).
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 974 (S. 3).
- ↑ Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, S. 7.
- ↑ Bernd Schierwater, Michael Eitel, Wolfgang Jakob, Hans-Jürgen Osigus, Heike Hadrys, Stephen L. Dellaporta, Sergios-Orestis Kolokotronis, Rob DeSalle: Concatenated Analysis Sheds Light on Early Metazoan Evolution and Fuels a Modern "Urmetazoon" Hypothesis. In: PLoS Biology. Band 7, 2009, Artikel Nr. e1000020, doi:10.1371/journal.pbio.1000020, S. 40–42.
- ↑ Claus Nielsen Life cycle evolution: was the eumetazoan ancestor a holopelagic, planktotrophic gastraea?. In: BMC Evolutionary Biology. Band 13, 2013, Artikel Nr. 171, doi:10.1186/1471-2148-13-171, S. 14–15.
- ↑ Claus Nielsen: Early animal evolution: A morphologist's view. In: Royal Society Open Science. Band 6, 2019, Artikel Nr. 190638, doi:10.1098/rsos.190638, S. 4, 6.
- ↑ Shuhai Xiao, Xunlai Yuan, Andrew H. Knoll: Eumetazoan fossils in terminal Proterozoic phosphorites? In: PNAS. Band 97, 2000, doi:10.1073/pnas.250491697, S. 13687–13688.
- ↑ John A. Cunningham, Kelly Vargas, Liu Pengju, Veneta Belivanova, Federica Marone, Carlos Martínez-Pérez, Manuel Guizar-Sicairos, Mirko Holler, Stefan Bengtson, Philip C. J. Donoghue: Critical appraisal of tubular putative metazoans from the Ediacaran Weng’an Dushantuo biota. In: Proceedings of the Royal Society of London • Series B. Band 282. 2015, doi:10.1098/rspb.2015.1169, S. 7–8.
- ↑ Scott D. Evans, Ian V. Hughes, James G. Gehling, and Mary L. Droser: Discovery of the oldest bilaterian from the Ediacaran of South Australia. In: PNAS. Band 117, 2020, doi:10.1073/pnas.2001045117, S. 7845.
- ↑ Shuhai Xiao, Marc Laflamme: On the eve of animal radiation: phylogeny, ecology and evolution of the Ediacara biota. In: Trends in Ecology and Evolution. Band 24, 2009, doi:10.1016/j.tree.2008.07.015, S. 34.
- ↑ Graham E. Budd, Maximilian J. Telford: The origin and evolution of arthropods. In: Nature. Band 457, 2009, doi:10.1038/nature07890, S. 814.
- ↑ Mikhail A. Fedonkin, Benjamin M Waggoner: The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism. In: Nature. Band 388, 1997, S. 869.
- ↑ Ilya Bobrovskiy, Janet M. Hope, Andrey Ivantsov, Benjamin J. Nettersheim, Christian Hallmann, Jochen J. Brocks: Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. In: Science, Band 361, 2018, doi:10.1126/science.aat7228, S. 1248.
- ↑ John A. Cunningham, Alexander G. Liu, Stefan Bengtson, Philip C. J. Donoghue: The origin of animals: Can molecular clocks and the fossil record be reconciled? In: BioEssays. Band 39, 2016, doi:10.1002/bies.201600120, S. 5.
- ↑ James D. Schiffbauer, Tara Selly, Sarah M. Jacquet, Rachel A. Merz, Lyle L. Nelson, Michael A. Strange, Yaoping Cai, Emily F. Smith: Discovery of bilaterian-type through-guts in cloudinomorphs from the terminal Ediacaran Period. In: Nature Communications. Band 11, 2020, Artikel-Nr. 205, S. 9.
- ↑ Zhe Chen, Chuanming Zhou, Xunlai Yuan, Shuhai Xiao: Death march of a segmented and trilobate bilaterian elucidates early animal evolution. In: Nature. Band 573, 2019, S. 412.
- ↑ Amy J. Shore, Rachel A. Wood, Ian B. Butler, Andrey Yu. Zhuravlev, Sean McMahon, Alexandra Curtis, Fred T. Bowyer: Ediacaran metazoan reveals lophotrochozoan affinity and deepens root of Cambrian Explosion. In: Science Advances. Band 7, 2021, Artikel Nr. eabf2933, doi:10.1126/sciadv.abf2933, S. 1.
- ↑ Roger E. Summons, Douglas H. Erwin: Chemical clues to the earliest animal fossils. In: Science. Band 361, 2018, doi:10.1126/science.aau9710, S. 1198–1199.
- ↑ Erik A. Sperling, Jakob Vinther: A placozoan affinity for Dickinsonia and the evolution of the late Proterozoic metazoan feeding modes. In: Evolution and Development. Band 12, 2010, doi:10.1111/j.1525-142X.2010.00404.x, S. 201.
- ↑ 173,0 173,1 Joshua J. Williams, Benjamin J. W. Mills, Timothy M. Lenton: A tectonically driven Ediacaran oxygenation event. In: Nature Communications. Band 10, 2019, Artikel Nr. 2690, doi:10.1038/s41467-019-10286-x, S. 1.
- ↑ Feifei Zhang, Shuhai Xiao, Brian Kendall, Stephen J. Romaniello, Huan Cui, Mike Meyer, Geoffrey J. Gilleaudeau, Alan J. Kaufman, Ariel D. Anbar: Extensive marine anoxia during the terminal Ediacaran Period. In: Science Advances. Band 4, 2018, Artikel Nr. eaan8983, doi:10.1126/sciadv.aan8983, S. 1, 7.
- ↑ Tianchen He, Maoyan Zhu, Benjamin J. W. Mills, Peter M. Wynn, Andrey Yu. Zhuravlev, Rosalie Tostevin, Philip A. E. Pogge von Strandmann, Aihua Yang, Simon W. Poulton, Graham A. Shields: Possible links between extreme oxygen perturbations and the Cambrian radiation of animals. In: Nature Geoscience. Band 12, 2019, S. 468.
- ↑ Jens Boenigk, Sabina Wodniok: Biodiversität und Erdgeschichte. Springer-Verlag, Berlin/Heidelberg 2014, ISBN 978-3642553882, S. 104.
| Dieser Artikel wurde am 28. Januar 2021 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |
| Dieser Artikel basiert ursprünglich auf dem Artikel Choanozoa aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |