| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Aluminium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Aluminium, Al, 13 | ||||||||||||||||||||||||||||||||||||
| Serie | Metalle | ||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 13, 3, p | ||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig | ||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7429-90-5 | ||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 7,57 %[1] | ||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||
| Atommasse | 26,9815385(7) [3] u | ||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 125 (118) pm | ||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 121 pm | ||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 184[4] pm | ||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ne] 3s2 3p1 | ||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,06–4,26 eV [5] | ||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 577,5 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1816,7 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2744,8 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||
| Dichte | 2,7 g/cm3 | ||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,75 | ||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 2,1 · 10−5)[6] | ||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 933,35 K (660,2 [7] °C) | ||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2743 K[8] (2470 °C) | ||||||||||||||||||||||||||||||||||||
| Molares Volumen | 10,00 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 284 kJ/mol[8] | ||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 10,7 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 6250-6500 (Longitudinalwelle); 3100 (Scherwelle)[9][10] m/s bei 293,15 K | ||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 897[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 37,7 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 235 W/(m · K) | ||||||||||||||||||||||||||||||||||||
| Mechanisch [2] | |||||||||||||||||||||||||||||||||||||
| E-Modul | 70000 N/mm²[11] | ||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0,34[12] | ||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 1, 2, 3 | ||||||||||||||||||||||||||||||||||||
| Oxide (Basizität) | Al2O3 (amphoter) | ||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,676 V (Al3+ + 3 e− → Al) | ||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,61 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||
Aluminium ist ein chemisches Element mit dem Elementsymbol Al und der Ordnungszahl 13. Im Periodensystem gehört Aluminium zur dritten Hauptgruppe und zur 13. IUPAC-Gruppe, der Borgruppe, die früher auch als Gruppe der Erdmetalle bezeichnet wurde. Aluminium ist ein silbrig-weißes Leichtmetall. Es ist das dritthäufigste Element und häufigste Metall in der Erdkruste. 2010 wurden 41 Mio. t Primäraluminium hergestellt.[16] Obwohl das Metall sehr unedel ist, reagiert es wegen Passivierung bei Raumtemperatur nur oberflächlich mit Luft und Wasser.
Geschichte
Aluminium ist im Vergleich zu anderen Metallen noch nicht lange bekannt. Erst im Jahre 1808 beschrieb es Sir Humphry Davy als „Aluminum“ und versuchte seine Herstellung. Dies gelang Hans Christian Ørsted erstmalig im Jahr 1825, durch Reaktion von Aluminiumchlorid (AlCl3) mit Kaliumamalgam, wobei Kalium als Reduktionsmittel dient:[17]

Friedrich Wöhler verwendete 1827 die gleiche Methode, verwendete zur Reduktion jedoch metallisches Kalium und erhielt damit ein reineres Aluminium. Zu jener Zeit kostete Aluminium mehr als Gold.
Henri Étienne Sainte-Claire Deville verfeinerte den Wöhler-Prozess im Jahr 1846 und publizierte ihn 1859 in einem Buch. Durch den verbesserten Prozess stieg die Ausbeute bei der Aluminiumgewinnung, was dazu führte, dass der Aluminiumpreis innerhalb von zehn Jahren um 90 % fiel.
1886 wurde unabhängig voneinander durch Charles Martin Hall und Paul Héroult das jetzt nach ihnen benannte Elektrolyseverfahren zur Herstellung von Aluminium entwickelt: der Hall-Héroult-Prozess. 1889 entwickelte Carl Josef Bayer das nach ihm benannte Bayer-Verfahren zur Aluminiumherstellung. Aluminium wird noch heute nach diesem Prinzip großtechnisch hergestellt.
Am Ende des 19. Jahrhunderts stand das Metall in solchem Ansehen, dass man daraus gefertigte Metallschiffe durchaus auf den Namen Aluminia taufte.
Namensgebung
Der Elementname leitet sich vom lateinischen Wort alumen für Alaun ab. Zwei Namen für das Element sind in Gebrauch: Aluminium und Aluminum. Weltweit dominiert das erstere, während in den Vereinigten Staaten und im kanadischen Englisch der zweite Name geläufiger ist.[18] Die International Union of Pure and Applied Chemistry (IUPAC) beschloss im Jahr 1990, dass der Elementname Aluminium laute, akzeptierte 3 Jahre später aber auch Aluminum als mögliche Variante.
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Allerdings kommt es aufgrund seines unedlen Charakters praktisch ausschließlich in gebundener Form vor. Die größte Menge befindet sich chemisch gebunden in Form von Alumosilicaten, wo es in der Kristallstruktur die Position von Silicium in Sauerstoff-Tetraedern einnimmt. Diese Silikate sind zum Beispiel Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid in Form des Minerals Korund und seiner Varietäten Rubin (rot) und Saphir (farblos, verschiedenfarbig) gefunden. Die Farben dieser Kristalle beruhen auf Beimengungen anderer Metalloxide. Korund hat mit fast 53 % den höchsten Aluminiumanteil in der Verbindung. Einen ähnlich hohen Aluminiumanteil haben die noch selteneren Minerale Akdalait (~ 51 %) und Diaoyudaoit (~ 50 %). Insgesamt sind bisher (Stand: 2010) 1156 aluminiumhaltige Minerale bekannt.[19]
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Aluminiumproduktion ist Bauxit. Vorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den Vereinigten Staaten. Bauxit enthält ungefähr 60 % Aluminiumhydroxid (Al(OH)3 und AlO(OH)), etwa 30 % Eisenoxid (Fe2O3) und Siliciumdioxid (SiO2).
Bei der Herstellung unterscheidet man Primäraluminium, auch Hüttenaluminium genannt, das aus Bauxit gewonnen wird, und Sekundäraluminium aus Aluminiumschrott. Die Wiederverwertung benötigt dabei nur etwa 5 % Energie der Primärgewinnung.
Trotz seines unedlen Charakters kann Aluminium in der Natur auch elementar vorkommen. Hier tritt es sehr selten gediegen, das heißt elementar meist in Form von körnigen bis massigen Aggregaten auf, kann in seltenen Fällen aber auch tafelige Kristalle bis etwa einen Zentimeter Größe entwickeln.[20] Von der International Mineralogical Association (IMA) ist es daher in der Mineralsystematik nach Strunz unter der System-Nummer 1.AA.05 beziehungsweise veraltet unter I/A.03-05 als Mineral anerkannt. Gediegenes Aluminium konnte bisher (Stand: 2010) an rund 20 Fundorten nachgewiesen werden: In Aserbaidschan, Bulgarien, der Volksrepublik China (Guangdong, Guizhou und Tibet), Italien, Russland (Ostsibirien, Ural) und in Usbekistan. Auch auf dem Mond ist gediegenes Aluminium gefunden worden.[21] Aufgrund der extremen Seltenheit hat gediegenes Aluminium keine Bedeutung als Rohstoffquelle.
Gewinnung
Primäraluminium (Herstellung aus Mineralien)
Da Aluminium aus den Alumosilikaten aufgrund der Bindungsverhältnisse praktisch nicht isoliert werden kann, ist eine wirtschaftliche großtechnische Gewinnung von metallischem Aluminium nur aus Bauxit möglich. Das in diesem Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgeschlossen (Bayer-Verfahren, Rohrreaktor- oder Autoklaven-Aufschluss), um es von Fremdbestandteilen wie Eisen- und Siliciumoxid zu befreien und wird dann überwiegend in Wirbelschichtanlagen (aber auch in Drehrohröfen) zu Aluminiumoxid (Al2O3) gebrannt.
Der sogenannte trockene Aufschluss (Deville-Verfahren) hat dagegen keine Bedeutung mehr. Dabei wird feinstgemahlenes, ungereinigtes Bauxit zusammen mit Soda und Koks in Drehrohröfen bei rund 1200 °C kalziniert und das entstehende Natrium-Aluminat anschließend mit Natronlauge gelöst.
Die Herstellung von Aluminium erfolgt ausschließlich durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren (Hall-Héroult-Prozess). Zur Herabsetzung des Schmelzpunktes wird das Aluminiumoxid zusammen mit Kryolith geschmolzen (Eutektikum bei 963 °C).[22]
Der Prozess ist aufgrund der hohen Bindungsenergie des Aluminiums und seiner Dreiwertigkeit recht energieaufwändig. Der Energieeinsatz liegt bei 12,9–17,7 kWh pro produziertem Kilogramm Roh-Aluminium.[23][24] Energieeinsparungen sind möglich durch:[25]
- Reduzierung des Strombedarfs (nur in geringem Ausmaß, weil die Potentiale für energetische Optimierungen weitgehend erschlossen sind),
- Einsparungen bei der Stromherstellung aufgrund höherer Wirkungsgrade
- erhöhte Recyclingraten durch verbesserte Aussortierung, beispielsweise beim Schreddern in der Autoverwertung.
Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlendioxid und Kohlenstoffmonoxid reagiert.
Die Graphitblöcke, welche die Anode bilden, brennen wegen des im Prozess entstehenden Sauerstoffs langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphit-Kathode (Gefäßboden) ist gegenüber dem Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.
Die Aluminiumherstellung ist nur in der Nähe preiswert zur Verfügung stehender Elektroenergie wirtschaftlich.
| Land | Förderung | Reserven | Vorratsbasis |
|---|---|---|---|
| 63.000 | 5.800.000 | 7.900.000 | |
| 32.000 | 700.000 | 2.300.000 | |
| 20.000 | 770.000 | 1.400.000 | |
| 18.000 | 7.400.000 | 8.600.000 | |
| 15.000 | 2.000.000 | 2.500.000 |
Die nachfolgende Tabelle zeigt die Aluminiumproduktion und die maximal mögliche Produktionsleistung der Hüttenwerke nach Ländern.
| Rang | Land | Produktion | Kapazität |
|---|---|---|---|
| 1. | China | 13.000 | 19.000 |
| 2. | Russland | 3.300 | 5.150 |
| 3. | Kanada | 3.000 | 3.090 |
| 4. | Australien | 1.970 | 1.970 |
| 5. | USA | 1.710 | 3.500 |
| 6. | Indien | 1.600 | 2.000 |
| 7. | Brasilien | 1.550 | 1.700 |
| 8. | Norwegen | 1.200 | 1.230 |
| 9. | VAE | 950 | 950 |
| 10. | Bahrain | 870 | 880 |
| 11. | Südafrika | 800 | 900 |
| 12. | Island | 790 | 790 |
| 13. | Venezuela | 550 | 625 |
| 14. | Deutschland | 520 | 620 |
| 15. | Mosambik | 500 | 570 |
| 16. | Andere Länder | 4.600 | 6.920 |
| Welt | 36.900 | 49.900 |
Sekundäraluminium (Herstellung durch Aluminium-Recycling)
Um Aluminium zu recyceln werden Aluminiumschrotte und „Krätzen“ in Trommelöfen eingeschmolzen. „Krätze“ ist ein Abfallprodukt bei der Verarbeitung von Aluminium und bei der Herstellung von Sekundäraluminium. Krätze ist ein Gemisch aus Aluminiummetall und feinkörnigen Oxidpartikeln und wird beim Schmelzen von Aluminium bei 800 °C aus dem Aluminiumoxid der normalen Aluminiumkorrosion und als Oxidationsprodukt (Oxidhaut) beim Kontakt von flüssigem Aluminium mit Luftsauerstoff gebildet. Damit beim Aluminiumgießen keine Aluminiumoxidpartikel in das Gußteil gelangen wird die Krätze durch Kratzvorrichtungen von der Oberfläche des Metallbads abgeschöpft.
Um die Bildung von Krätze zu verhindern wird die Oberfläche der Schmelze mit Halogenidsalzen (rund zwei Drittel NaCl, ein Drittel KCl und geringe Mengen Calciumfluorid CaF2) abgedeckt (siehe dazu Aluminiumrecycling). Dabei entsteht als Nebenprodukt Salzschlacke, die noch ca. 10 % Aluminium enthält, die entsprechend aufbereitet, als Rohstoff für mineralische Glasfasern dient.[28]
Allerdings steht das Sekundäraluminium im Ruf, dass beim Recycling pro Tonne jeweils 300–500 Kilogramm Salzschlacke, verunreinigt mit Dioxinen und Metallen entsteht, deren mögliche Wiederverwertung aber Stand der Technik ist.[29][30]
Eigenschaften
Physikalische Eigenschaften
Aluminium ist ein relativ weiches und zähes Metall, die Zugfestigkeit von purem Aluminium liegt bei 49 MPa, die von seinen Legierungen bei 300 bis 700 MPa. Sein Elastizitätsmodul liegt je nach Legierung bei etwa 70.000 MPa. Es ist dehnbar und kann durch Auswalzen zu dünnen Folien verarbeitet werden. Sogenannte Aluminium-Knetlegierungen lassen sich auch bei niedrigen Temperaturen gut umformen, biegen, pressen und schmieden. Durch Kaltumformen entstandene Spannungen können durch Weichglühen (bis 250 °C) beseitigt werden. Auch Duraluminium ist bei dieser Temperatur verformbar.
Legierungen mit einem Anteil bis zu 3 % Magnesium oder Silicium lassen sich gut gießen (Aluminium-Druckguss) und spanabhebend bearbeiten.
Bei einer Sprungtemperatur von 1,2 K wird reines Aluminium supraleitend.
Der Schmelzpunkt liegt bei 660,4 °C und der Siedepunkt bei 2470 °C. Die Dichte von 2,7 g/cm³ bei Aluminium zeigt den Typus als Leichtmetall deutlich.
Chemische Eigenschaften

Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Diese passivierende Oxidschicht macht reines Aluminium bei pH-Werten von 4 bis 9 sehr korrosionsbeständig, sie erreicht eine Dicke von etwa 0,05 µm.[31]
Diese Oxidschicht schützt auch vor weiterer Oxidation, ist aber bei der elektrischen Kontaktierung und beim Schweißen hinderlich. Sie kann durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg verstärkt werden.
Die Oxidschicht kann mittels Komplexbildungsreaktionen aufgelöst werden. Einen außerordentlich stabilen und wasserlöslichen Neutralkomplex geht Aluminium in neutraler chloridischer Lösung ein. Folgende Reaktionsgleichung veranschaulicht den Vorgang:
Dies geschieht vorzugsweise an Stellen, wo die Oxidschicht des Aluminiums bereits geschädigt ist. Es kommt dort durch Bildung von Löchern zur Lochfraßkorrosion. Kann die chloridische Lösung dann an die freie Metalloberfläche treten, so laufen andere Reaktionen ab. Aluminium-Atome können unter Komplexierung oxidiert werden:
Liegen in der Lösung Ionen edlerer Metalle vor, so werden sie reduziert und am Aluminium abgeschieden. Auf diesem Prinzip beruht die Reduktion von Silberionen, die auf der Oberfläche von angelaufenem Silber als Silbersulfid vorliegen, hin zu Silber.
Aluminium reagiert heftig mit wässriger Natriumhydroxidlösung unter Bildung von Wasserstoff. Diese Reaktion wird in chemischen Rohrreinigungsmitteln ausgenutzt.
Die Reaktion von Al mit NaOH läuft folgendermaßen ab:
1. Schritt: Reaktion mit Wasser
Hier schließt sich im Normalfall die Trocknung der Oberfläche an, die eine Umwandlung des Hydroxids zum Oxid zur Folge hat:
Dies passiert jedoch nicht bei der Reaktion von Aluminium in wässriger Natronlauge.
2. Schritt: Komplexierung des Hydroxids zu Natriumaluminat
durch den zweiten Schritt wird das gallertartige Hydroxid wasserlöslich und kann von der Metalloberfläche abtransportiert werden. Dadurch ist die Aluminiumoberfläche nicht mehr vor dem weiteren Angriff des Wassers geschützt und Schritt 1 läuft wieder ab.
Mit dieser Methode lassen sich – ebenso wie bei der Reaktion von Aluminium mit Säuren – pro zwei Mol Aluminium drei Mol Wasserstoffgas herstellen.
Mit Brom reagiert Aluminium bei Zimmertemperatur unter Flammenerscheinung. Hierbei ist zu beachten, dass das entstehende Aluminiumbromid mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure reagiert.
Mit Quecksilber bildet Aluminium ein Amalgam. Wenn Quecksilber direkt mit Aluminium zusammenkommt (d. h. wenn die Aluminiumoxidschicht an dieser Stelle mechanisch zerstört wird), frisst das Quecksilber Löcher in das Aluminium; unter Wasser wächst dann darüber Aluminiumoxid in Gestalt eines kleinen Blumenkohls. Daraus ist abgeleitet, dass Quecksilber in der Luftfahrt als Gefahrgut und „ätzende Flüssigkeit“ gegenüber Aluminiumwerkstoffen behandelt wird.[32] Mit Salzsäure reagiert Aluminium auch sehr heftig unter Wasserstoffentwicklung, von Schwefelsäure wird es langsam aufgelöst. In Salpetersäure wird es passiviert.
In Pulverform (Partikelgröße < 500 µm) ist Aluminium vor allem dann, wenn es nicht phlegmatisiert ist, aufgrund seiner großen Oberfläche sehr reaktiv. Aluminium reagiert dann mit Wasser unter Abgabe von Wasserstoff zu Aluminiumhydroxid. Feinstes, nicht phlegmatisiertes Aluminiumpulver wird auch als Pyroschliff bezeichnet. Nicht phlegmatisierter Aluminiumstaub ist sehr gefährlich und entzündet sich bei Luftkontakt explosionsartig von selbst.
Verwendung
Der Aluminiumpreis bewegt sich am Weltmarkt seit ca. 2005 um den Wert von 2000 Euro pro Tonne herum (Reinheit von 99,7 %, Stand: Oktober 2013).[33]
Konstruktionswerkstoff
Wegen seiner geringen Dichte wird Aluminium gern dort verwendet, wo es auf geringe Masse ankommt, die zum Beispiel bei Transportmitteln zum geringeren Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Auch im Fahrzeugbau gewann es aus diesem Grund an Bedeutung; hier standen früher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Dauerbruchfestigkeit und die Verformungseigenschaften bei Unfällen (geringes Energieaufnahmevermögen in der sogenannten Knautschzone) im Wege. Schon in den 1930er Jahren verwendete ein amerikanisches Unternehmen Aluminium, um ein militärisches Amphibienfahrzeug leichter zu machen. Beim Bau von kleinen und mittleren Yachten wird die Korrosionsbeständigkeit von speziell legiertem Aluminium gegenüber Salzwasser geschätzt, die sich nach Bildung einer dünnen, schützenden Oxidschicht an der Oberfläche ergibt.[34] Transportmittel machten 2010 mit ca. 35 % den größten Anteil an der Verwendung von Aluminium aus.[16]
In Legierungen mit Magnesium, Silicium und anderen Metallen werden Festigkeiten erreicht, die denen von Stahl nur wenig nachstehen. Daher ist die Verwendung von Aluminium zur Gewichtsreduzierung überall dort angebracht, wo Materialkosten eine untergeordnete Rolle spielen. Insbesondere im Flugzeugbau und in der Weltraumtechnik sind Aluminium und Duraluminium weit verbreitet. Der größte Teil der Struktur heutiger Verkehrsflugzeuge wird aus Aluminiumblechen verschiedener Stärken und Legierungen genietet. Bei den neusten Modellen (Boeing 787, Airbus A350) wird Aluminium größtenteils durch den noch leichteren kohlenstofffaserverstärkten Kunststoff (CFK) verdrängt. Ganz ähnliche Entwicklungen – zeitlich und hin zu leichteren Ausführungen – von Holz über Stahl zu Alu und weiter zu Kohlenstoff- oder Glasfaserverbund sind an Rahmen und Felgen des Fahrrads, sowie an Zeltstangen und Stöcken etwa zum Schifahren zu beobachten. In einigen Anwendungfällen etablieren sich Aluminiumwerkstoffe als dominierend: Fahrradfelgen aus Strangprofil, Motorrad- und modisch gestaltete Autofelgen aus Aluguss, biegsames gefädeltes Gestänge von Kuppelzelten, teleskopierbare Stöcke zum Schitourengehen beides aus Rohr, Kamerastativbeine jedoch daneben auch aus Profil.
Aluminium lässt sich durch Strangpressen in komplizierte Konstruktionsprofile formen, hierin liegt ein großer Vorteil bei der Fertigung von Hohlprofilen (Automatisierungstechnik, Messebau), Kühlkörperprofilen oder in der Antennentechnik. Aluminium-Gussteile können durch Druckguss in komplizierten Formen gefertigt werden; die spanende Nachbearbeitung ist gut möglich.
Mit Aluminium werden Heizelemente von Bügeleisen und Kaffeemaschinen umpresst.
Bevor es gelang, Zinkblech durch Titanzusatz als so genanntes Titanzink verarbeitbar zu machen, wurde Aluminiumblech für Fassaden- und Dachelemente (siehe Leichtdach) sowie Dachrinnen eingesetzt.
Aluminiumlegierungen
Aluminium kann im schmelzflüssigen Zustand mit Kupfer, Magnesium, Mangan, Silicium, Eisen, Titan, Beryllium, Lithium, Chrom, Zink, Zirconium und Molybdän legiert werden, um bestimmte Eigenschaften zu fördern oder andere, ungewünschte Eigenschaften zu unterdrücken.
Bei den meisten Legierungen ist jedoch die Bildung der schützenden Oxidschicht (Passivierung) stark gestört, wodurch die daraus gefertigten Bauteile teils hochgradig korrosionsgefährdet sind. Nahezu alle hochfesten Aluminiumlegierungen sind von dem Problem betroffen.
Es gibt Aluminiumknetlegierungen (AW, englisch wrought), zum Beispiel AlMgMn, und Aluminiumgusslegierungen (AC, englisch cast). Aluminiumgusslegierungen werden zum Beispiel für Leichtmetallfelgen verwendet.
Im Allgemeinen werden Aluminiumlegierungen nach dem System der AA (Aluminum Association) bezeichnet:
- Aluminiumgusslegierungen – Herstellung von Motoren- und Getriebegehäusen. Typische Aluminiumgusslegierungen sind: AlSi, AlSiCu, AlSiMg, AlCuTi, AlMg
- Aluminiumknetlegierungen – Platten und Bandproduktion durch Warm- und Kaltumformen (Walzen, Strangpressen, Schmieden).
- Typische „naturharte“ Aluminiumknetlegierungen sind: AlMg, AlMn, AlMgMn, AlSi
- „Aushärtbare“ Knetlegierungen – Festigkeitssteigerung durch Ausscheidung von Legierungselementen bei einer zusätzlichen Alterungsglühung bei 150 bis 190 °C. Typische „aushärtbare“ Aluminiumknetlegierungen sind: AlMgSi, AlCuMg, AlZnMg, AlZnMgCu. Die erste hochfeste, aushärtbare Aluminiumlegierung AlCuMg bekam 1907 den Markennamen Duraluminium.
Elektrotechnik

Aluminium ist ein guter elektrischer Leiter: Aluminium leitet Strom je Gramm Masse besser als Kupfer, ist aber voluminöser als dieses, so dass Kupfer je Quadratzentimeter Leitungsquerschnitt Strom besser leitet als Aluminium. Weil Kupfer reaktionsträger und die Verarbeitung weniger problematisch als bei Aluminium ist, wird meistens Kupfer verwendet und Aluminium nur, wenn es auf das Gewicht ankommt.
Aluminium wird insbesondere dann als Leitermaterial für elektrischen Strom im Stromnetz verwendet, wenn es sich um starre und dicke Leitungen handelt (Stromschienen, Erdkabel). Hier bietet es Kostenvorteile gegenüber Kupfer.
Beim Kontaktieren ist problematisch, dass Aluminium unter dem Druck der Kontaktierung zum Kriechen neigt. Außerdem überzieht es sich an Luft spontan mit einer Oxidschicht. Nach längerer Lagerung oder intensivem Kontakt mit Wasser ist diese isolierende Schicht so dick, dass sie vor der Kontaktierung beseitigt werden muss. Aluminium fand vorübergehend ab ca. 1960 Anwendung als Leitermaterial in Gebäudeinstallationen – aufgrund ungeeigneter Klemmen kam es zu Ausfällen und sogar Bränden aufgrund sich lösender Kontakte. Crimpverbindungen mit passenden Hülsen und Werkzeugen sind jedoch sicher. Als Zwischenlage zwischen Kupfer und Aluminium können Verbindungsstücke aus Cupal die Kontaktprobleme vermeiden.
Vorübergehend gab es für Hausinstallationen so genannte Alcu-Kabel, bei diesen sollte eine Verkupferung der Aluminiumadern zu besserer Kontaktgabe führen – das Kriechen beim hohen Kontaktdruck einer Schraubklemme konnte jedoch auch dadurch nicht beseitigt werden.
Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine stark absinkende Leitfähigkeit zeigt.
Aluminium wird daher nicht nur zu Stromschienen in Umspannwerken, sondern auch zu stromführenden Gussteilen verarbeitet.
Aluminium wird auch in Überlandleitungen (Freileitungen) als eines von mehreren Leitungsmaterialien verwendet – die geringe Dichte ist hier ausschlaggebend. Kupferleitungen mit der gleichen Leitfähigkeit hätten zwar einen geringeren Querschnitt, jedoch etwa die doppelte Masse. Aus dem gleichen Grund werden im Airbus A380 ebenfalls Aluminiumkabel verwendet.
Für Oberleitungen ist es dagegen aufgrund seiner schlechten Kontakt- und Gleiteigenschaften ungeeignet.
Aluminium wird zur Fertigung von Kurzschlussläufern von Asynchronmotoren verwendet, indem deren Blechpakete umgossen werden.
Elektronik

Die Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen Leitfähigkeit und Wärmeleitfähigkeit ein.
Bonddrähte (Verbindungsdrähte zwischen Chip und Gehäuseanschluss) bestehen insbesondere bei Leistungshalbleitern aus Aluminium.
Die Leiterbahnen integrierter Schaltkreise und von Leistungshalbleitern bestehen oft ebenfalls aus Aluminium.
Wegen seiner hohen Wärmeleitfähigkeit wird Aluminium als Werkstoff für Wärmeübertrager (Kühler), stranggepresste Kühlprofile und wärmeableitende Grundplatten verwendet (bei höherwertigen Kühlern wird allerdings wegen der höheren Wärmeleitfähigkeit Kupfer eingesetzt).
Aluminium-Elektrolytkondensatoren verbauen Aluminium als Elektrodenmaterial und Gehäusewerkstoff.
Aluminium wird zur Herstellung von Antennen und Hohlleitern verwendet.
Verpackung und Behälter


In der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie zu Aluminiumfolie verarbeitet. Dabei macht man sich die Eigenschaft der absoluten Barrierewirkung gegenüber Sauerstoff, Licht und anderen Umwelteinflüssen bei gleichzeitig relativ geringem Gewicht zunutze, um Lebensmittel zu schützen. Dünne Folien werden in Stärken von 6 Mikrometer hergestellt und dann zumeist in Verbundsystemen eingesetzt, beispielsweise in Tetra Paks. Kunststofffolien können durch Bedampfen mit Aluminium mit einer dünnen Schicht versehen werden, welche dann eine hohe (aber nicht vollständige) Barrierefunktion aufweist.
Aus Aluminium werden auch Kochtöpfe und andere Küchengeräte, wie die klassische italienische Espressokanne, sowie Reise- und Militär-Geschirr hergestellt.
Die Aufbewahrung und Zubereitung von säurehaltigen Lebensmitteln in Aluminiumbehältern beziehungsweise -folie ist problematisch, da es dabei lösliche Aluminiumsalze bildet, die mit der Nahrung aufgenommen werden. Aluminiumschichten in Verpackungsmitteln werden daher häufig durch eine Kunststoffschicht geschützt.
Aluminium wird für eine Vielzahl von Behältern und Gehäusen verarbeitet, da es sich gut durch Umformen bearbeiten lässt. Gegenstände aus Aluminium werden häufig durch eine Eloxalschicht vor Oxidation und Abrieb geschützt.
Optik und Lichttechnik
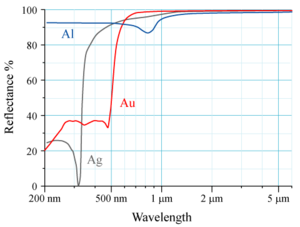
Aluminium wird aufgrund seines hohen Reflexionsgrades als Spiegelbeschichtung von Oberflächenspiegeln, unter anderem in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras eingesetzt. Es reflektiert im Gegensatz zu Silber auch Ultraviolettstrahlung. Aluminium-Spiegelschichten werden meist durch eine Schutzschicht vor Korrosion und Kratzern geschützt.
Weitere Anwendungen
In der Raketentechnik besteht der Treibstoff von Feststoffraketen zu maximal 30 % aus Aluminiumpulver, das bei seiner Verbrennung viel Energie freisetzt.[35] Aluminium wird in Feuerwerken (s. a. Pyrotechnik) verwendet, wo es je nach Körnung und Mischung für farbige Effekte sorgt.[36] Ebenso ist es neben Eisen(III)-oxid Bestandteil der stark exothermen (bis zu 2500 °C) Thermit-Reaktion beim aluminothermischen Schweißen.
Aluminiumpulver und Aluminiumpasten werden zur Herstellung von Porenbeton eingesetzt und es dient als Pigment für Farben (Silber- oder Goldbronze). Farbig eloxiert ist es Bestandteil vieler Dekorationsmaterialien wie Flitter, Geschenkbänder und Lametta. Zur Beschichtung von Oberflächen wird es beim Aluminieren verwendet.
Verarbeitungsverfahren
Aluminium wird meist legiert verwendet. Es gibt eine Vielzahl von Legierungen, die entweder gute Verformbarkeit oder gute Gießbarkeit und spanende Bearbeitbarkeit zeigen.
Aluminium wird durch Gießen beziehungsweise Umformen in Aluminiumgießereien nach folgenden Gießverfahren verarbeitet:
- Sandguss
- Strangguss
- Druckguss bzw. Aluminiumdruckguss
- Feinguss
- Kokillenguss (gegebenenfalls mit Sandkern)
- Bandguss
- Sprühkompaktieren
Hierbei werden Verfahren unterschieden, die der Herstellung (fast) fertiger Bauteile dienen (z. B. Sandguss, Druckguss, Feinguss) und solchen, die Rohmaterial für die Weiterverarbeitung zu Halbzeug wie Blechen und Strangpressprofilen liefern (z. B. Strangguss). Sprühkompaktieren und Bandguss nehmen eine Sonderstellung ein.
Die Herstellung von Halbzeug oder Bauteilen geschieht aus Vormaterial wie etwa Walzbarren, Blech oder Zylindern durch Umformen:
- Strangpressen
- Walzen
- Schmieden
- Floatforming (Fließpressen)
- Tiefziehen
- Rollen
- Cobapress
Die spanende Bearbeitung birgt die Gefahr einer Aufbauschneide und erfordert spezielle Kühlschmiermittel. Aluminium kann daher auch nur mit speziellen Schleifscheiben geschliffen werden.
Insbesondere die Bearbeitung von eloxierten Werkstücken erfordert harte Werkzeuge, um Verschleiß durch die harte Eloxalschicht zu vermeiden.
Aluminium in Natur und Organismen
Aluminium im menschlichen Körper
Aluminium ist kein essenzielles Spurenelement und gilt für die menschliche Ernährung, wie auch Silber und Gold, als entbehrlich.[37] Im menschlichen Körper befinden sich durchschnittlich etwa 50 bis 150 Milligramm Aluminium.[38] Diese verteilen sich zu ungefähr 50 % auf das Lungengewebe, zu 25 % auf die Weichteile und zu weiteren 25 % auf die Knochen. Aluminium ist damit als Spurenelement ein natürlicher Bestandteil unseres Körpers.
99–99,9 % der üblicherweise in Lebensmitteln pro Tag aufgenommenen Menge von Aluminium (10–40 mg) werden unresorbiert über den Kot wieder ausgeschieden. Chelatbildner (Komplexbildner) wie Citronensäure können die Resorption auf zwischen zwei und drei Prozent steigern. Auch die Aufnahme von Aluminiumsalzen über den Magen-Darm-Trakt ist gering; sie variiert aber in Abhängigkeit von der chemischen Verbindung und ihrer Löslichkeit, dem pH-Wert und der Anwesenheit von Komplexbildnern. Die Eliminierung von in den Organismus gelangten wasserlöslichen Aluminiumsalzen erfolgt vorwiegend über den Urin, weniger über den Kot. Bei Dialysepatienten mit einer eingeschränkten Nierenfunktion besteht daher ein erhöhtes Risiko einer Akkumulation im Körper mit toxischen Effekten, etwa Knochenerweichungen und Schäden des Zentralnervensystems; zusätzlich sind Dialysepatienten aufgrund für sie notwendiger pharmazeutischer Produkte (Phosphatbinder) einer höheren Aluminiumzufuhr ausgesetzt.[38]
Pflanzen
Aluminium in Form verschiedener Salze (Phosphate, Silikate) ist Bestandteil vieler Pflanzen und Früchte, denn gelöste Al-Verbindungen werden durch Regen aus den Böden von den Pflanzen aufgenommen, bei Säurebelastung der Böden infolge sauren Regens[39] ist dies vermehrt der Fall (siehe dazu auch Waldsterben).
Ein großer Teil des Bodens auf der Welt ist chemisch sauer. Liegt der pH-Wert unter 5,0, werden Al3+-Ionen von den Wurzeln der Pflanzen aufgenommen. Dies ist bei der Hälfte des bebaubaren Lands auf der Welt der Fall. Die Ionen schädigen insbesondere das Wurzelwachstum an den Spitzen der Wurzeln. Die Pflanze, wenn sie nicht Aluminium-tolerant ist, steht dann unter Stress. Zahlreiche Enzyme und signalübertragenden Proteine sind betroffen; die Folgen der Vergiftung sind noch nicht vollständig bekannt. In sauren metallhaltigen Böden ist Al3+ das Ion mit dem größten Potenzial zur Schädigung. Von der Modellpflanze Arabidopsis sind Transgene bekannt, die deren Aluminium-Toleranz heraufsetzen und auch bei Kulturpflanzen sind tolerante Sorten bekannt.[40][41][42][43]
In Lebensmitteln
| Lebensmittel [44] | Aluminium-Gehalt in mg/kg |
|---|---|
| Tee (Trockenerzeugnisse) | 385 |
| Kakao und Schokolade | 100 |
| Salatarten | 28,5 |
| Hülsenfrüchte | 22,5 |
| Getreide | 13,7 |
| Pilzkonserven | 9,3 |
| Kohlarten | 9,0 |
| Wurstwaren | 7,8 |
| Gemüsekonserven | 7,6 |
| Obstkonserven | 3,6 |
| Fische und Fischerzeugnisse | 3,3 |
| Obst | 3,1 |
| Kindernahrung | 3,0 |
| Käse | 2,9 |
| Frischpilze | 2,7 |
| Paprika, Gurken, Tomaten, Melonen | 2,2 |
| Kartoffeln | 2,1 |
| Fleisch | 1,2 |
Die meisten Lebensmittel enthalten als Spurenelement auch Aluminium. Unverarbeitete pflanzliche Lebensmittel enthalten durchschnittlich weniger als 5 mg/kg in der Frischmasse. Dabei streuen die Werte aufgrund unterschiedlicher Sorten, Anbaubedingungen und Herkunft in erheblichen Maße.[45] So weisen beispielsweise Salat und Kakao deutlich höhere Durchschnittswerte auf. Schwarzer Tee kann Gehalte von bis zu 1042 mg/kg in der Trockenmasse aufweisen.[46]
Beim Kochen oder Aufbewahren in Aluminiumgeschirr oder in Alufolie kann es (außer bei sauren Lebensmitteln) nach einer Schätzung zu einer maximalen zusätzlichen Aufnahme von 3,5 mg/Tag/Person kommen. Bei sauren Lebensmitteln wie Sauerkraut oder auch Tomaten können aufgrund der Säurelöslichkeit wesentlich höhere Werte erreicht werden.[47]
Trink- und Mineralwässer weisen mit durchschnittlich 0,2 bis 0,4 mg/l im Gegensatz zur Nahrung geringe Gehalte auf und stellen somit nur einen kleinen Beitrag zur täglichen Aluminium-Aufnahme.[45][47] Die Trinkwasserverordnung legt einen Grenzwert von 0,2 mg/l fest. Trinkwasser darf in Deutschland, Österreich und der Schweiz keine höheren Werte aufweisen.
Nach einer Schätzung nimmt der erwachsene Europäer im Durchschnitt zwischen 1,6 und 13 mg Aluminium pro Tag über die Nahrung auf. Dies entspricht einer wöchentlichen Aufnahme von 0,2 bis 1,5 mg Aluminium pro kg Körpergewicht bei einem 60 kg schweren Erwachsenen. Die großen Unsicherheiten beruhen auf den unterschiedlichen Ernährungsgewohnheiten und der variablen Gehalte an Aluminium in den Lebensmitteln.[45]
Die Europäische Behörde für Lebensmittelsicherheit (Efsa) legt eine tolerierbare wöchentliche Aufnahme (TWI) von 1 Milligramm Aluminium pro Kilogramm Körpergewicht fest.[48]
Aluminium ist als Lebensmittelzusatzstoff unter der Bezeichnung E 173 ausschließlich als Farbstoff für Überzüge von Zuckerwaren und als Dekoration von Kuchen und Keksen erlaubt. Weiterhin ist Aluminium zum Färben von Arzneimitteln und Kosmetika zugelassen.[49]
Bei der Untersuchung von Laugengebäck (Brezeln, Stangen, Brötchen) aus Bäckereien wurde Aluminium nachgewiesen, das in das Lebensmittel gelangt, wenn bei der Herstellung von Laugengebäck Aluminiumbleche verwendet werden.[50]
Während Bier in Aluminiumfässern transportiert wird, hat sich für den Weintransport der Werkstoff Aluminium nicht durchgesetzt. Ein kurzfristiger Kontakt schadet nicht, doch können nach längerem Kontakt Weinfehler in Geruch und Geschmack oder als Trübung auftreten, vor allem beim offenen Stehen an der Luft.[51]
Toxizität
Bei eingeschränkter Nierenfunktion und bei Dialyse-Patienten führt die Aufnahme von Aluminium zu progressiver Enzephalopathie (Gedächtnis- und Sprachstörungen, Antriebslosigkeit und Aggressivität) durch Untergang von Hirnzellen und zu fortschreitender Demenz, zu Osteoporose (Arthritis) mit Knochenbrüchen und zu Anämie[52](weil Aluminium dieselben Speichereiweiße wie Eisen besetzt).
Trotz seiner Anwendung in Deodorants und Lebensmittel-Zusatzstoffen werden die gesundheitlichen Auswirkungen von Aluminium kontrovers diskutiert.[53][54] So wurde Aluminium mehrfach kontrovers als Faktor im Zusammenhang mit der Alzheimer-Krankheit in Verbindung gebracht.[54]
Laut einer Studie des Bundesinstituts für Risikobewertung (BfR) vom Juli 2007 wurde im allgemeinen Fall zum Zeitpunkt der Erstellung der Studie aufgrund der vergleichsweise geringen Menge kein Alzheimer-Risiko durch Aluminium aus Bedarfsgegenständen erkannt; jedoch sollten vorsorglich keine sauren Speisen in Kontakt mit Aluminiumtöpfen oder -folie aufbewahrt werden.[47] Eine Neubewertung erfuhr im Februar 2014 die Verwendung von aluminiumhaltigen Deodorants und Kosmetikartikel durch das Bundesinstitut für Risikobewertung: Aluminiumsalze aus solchen Produkten können durch die Haut aufgenommen werden, und die regelmäßige Benutzung über Jahrzehnte hinweg könnte möglicherweise zu gesundheitlichen Beeinträchtigungen beitragen.[55]
Die britische Alzheimer Gesellschaft mit Sitz in London vertritt den Standpunkt, dass die bis 2008 erstellten Studien einen kausalen Zusammenhang zwischen Aluminium und der Alzheimer-Krankheit nicht überzeugend nachgewiesen haben.[56] Dennoch gibt es einige Studien, wie z. B. die PAQUID-Kohortenstudie in Frankreich, mit einer Gesundheitsdatenauswertung von 3777 Personen im Alter ab 65 Jahren seit 1988 bis zur Gegenwart[57], in welchen eine Aluminium-Exposition als Risikofaktor für die Alzheimer-Krankheit angegeben wird. Demnach wurden viele senile Plaques mit erhöhten Aluminium-Werten in Gehirnen von Alzheimer-Patienten gefunden. Es ist jedoch unklar, ob die Aluminium-Akkumulation eine Folge der Alzheimer-Krankheit ist, oder ob Aluminium in ursächlichem Zusammenhang mit der Alzheimer-Krankheit zu sehen ist.[58]
Aspekte des Umweltschutzes

Die Herstellung von Aluminium ist sehr energieaufwendig. Allein für die Schmelzflusselektrolyse zur Gewinnung eines Kilogramms Aluminium werden je nach Errichtungsdatum und Modernität der Anlage zwischen 12,9 und 17,7 kWh elektrische Energie benötigt.[24] Anschaulich formuliert benötigt die Schmelzflusselektrolyse eines Kilogramms Roh-Aluminium für eine Autofelge so viel Energie wie der Betrieb eines 24-Zoll-LCD-Flachbildschirms (ca. 50 Watt) in einem Monat, wenn er täglich acht Stunden leuchtet. Bei der Stromerzeugung für die Produktion von einem Kilogramm Aluminium werden im deutschen Kraftwerkspark 8,4 kg CO2 freigesetzt, im weltweiten Durchschnitt etwa 10 kg. Es ist aber auch zu bedenken, dass aufgrund des Kostenfaktors Energie die Elektrolyse verstärkt an Orten erfolgt, an denen auf billige, CO2-emissionsarme Wasserkraft zurückgegriffen werden kann, wie etwa in Brasilien, Kanada, Venezuela oder Island.[59] Allerdings ist auch bei Verwendung von Elektrizität aus 100 % regenerativen Energien die Produktion von Aluminium nicht CO2-frei, da der bei der Schmelzflusselektrolyse entstehende Sauerstoff mit dem Kohlenstoff der Elektroden zu CO2 reagiert. Die Verbrauchswerte für Roh-Aluminium erhöhen sich noch durch Transport- und Verarbeitungsanteile für das Wiederaufschmelzen, Gießen, Schleifen, Bohren, Polieren etc., bis ein Konsumgut aus Aluminium entsteht.
In Österreich gelangen (laut einer Studie aus dem Jahr 2000)[60] 16.000 Tonnen Aluminium pro Jahr über Verpackungen in den Konsum, ebenso gelangen 16.000 Tonnen Aluminium ohne Wiederverwertung in den Hausmüll (dabei sind unter anderem auch die Aluminiumhaushaltsfolien eingerechnet, die nicht als „Verpackung“ gelten). 66 % der Verpackungen im Restmüll sind Aluminium[getränke]dosen. Diese liegen nach der Müllverbrennung in der Asche noch metallisch vor und machen in Europa durchschnittlich 2,3 % der Asche aus, werden aber derzeit nicht genutzt.[61]
Durch den Abbau des Erzes Bauxit werden große Flächen in Anspruch genommen, die erst nach einer Rekultivierung wieder nutzbar werden. Bei der Herstellung des Aluminiumoxids nach dem Bayer-Verfahren entstehen pro Kilogramm Aluminium ungefähr 1,5 Kilogramm eisenreicher alkalischer Rotschlamm, der kaum wiederverwertet wird und dessen Deponierung oder sonstige „Entsorgung“ große Umweltprobleme aufwirft (siehe dort und Bauxitabbau in Australien Umweltaspekte).
Positiv ist hingegen die gute Wiederverwendbarkeit von Aluminium hervorzuheben, wobei die Reststoffe streng getrennt erfasst und gereinigt werden müssen (Aluminiumrecycling, Recycling-Code-41 (ALU)). Aluminium ist dabei besser rezyklierbar als Kunststoffe, wegen Downcycling bei nicht sortenreiner Erfassung jedoch etwas schlechter wiederverwertbar als Stahl. Beim Aluminiumrecycling wird nur 5 % der Energiemenge der Primärproduktion benötigt.[62] Durch Leichtbau mit Aluminiumwerkstoffen (beispielsweise Aluminiumschaum, Strangpressprofile) wird Masse von beweglichen Teilen und Fahrzeugen gespart, was zur Einsparung von Treibstoff führen kann.
Aluminium ist durch seine Selbstpassivierung korrosionsbeständiger als Eisen und erfordert daher weniger Korrosionsschutzmaßnahmen.
Nachweis
Aluminiumsalze weist man durch Glühen mit verdünnter Kobaltnitratlösung auf der Magnesia-Rinne nach. Dabei entsteht das Pigment Thénards Blau (auch Kobaltblau oder Cobaltblau, Dumonts Blau, Coelestinblau, Leithners Blau, Cobaltaluminat). Es ist ein Cobaltaluminiumspinell mit der Formel CoAl2O4. Diese Nachweisreaktion wurde 1795 von Leithner durch Glühen von Aluminiumsulfat und Cobalt(II)-nitrat (Co(NO3)2) entdeckt.
Nachweis mittels Kryolithprobe
Die Probelösung wird alkalisch gemacht, um Aluminium als Aluminiumhydroxid Al(OH)3 zu fällen. Der Niederschlag wird abfiltriert und mit einigen Tropfen Phenolphthalein versetzt, dann gewaschen, bis keine Rotfärbung durch Phenolphthalein mehr vorhanden ist. Anschließend festes Natriumfluorid (NaF) auf den Niederschlag streuen: Es bildet sich eine Rotfärbung durch Phenolphthalein, verursacht von freigesetzten Hydroxidionen bei der Bildung von Kryolith Na3[AlF6].
Nachweis als fluoreszierender Morinfarblack
Die Probe wird mit Salzsäure (HCl) versetzt und eventuell vorhandenes Aluminium somit gelöst. Anschließend wird die Probelösung mit Kaliumhydroxid (KOH) stark alkalisch gemacht. Gibt man nun einige Tropfen der Probelösung zusammen mit der gleichen Menge Morin-Lösung auf eine Tüpfelplatte und säuert anschließend mit konzentrierter Essigsäure (Eisessig, CH3COOH) an, so ist unter UV-Strahlung (λ = 366 nm) eine grüne Fluoreszenz beobachtbar. Der Nachweis ist dann sicher, wenn diese Fluoreszenz bei Zugabe von Salzsäure wieder verschwindet.
Grund hierfür ist, dass Al(III) in neutralen sowie essigsauren Lösungen in Verbindung mit Morin eine fluoreszierende kolloidale Suspension bildet.
Verbindungen
- Aluminiumoxid Al2O3 (englisch alumina), auch als Tonerde oder Korund bekannt, liegt als weißes Pulver oder in Form sehr harter Kristalle vor. Es ist das Endprodukt des Bayer-Verfahrens und dient in erster Linie als Ausgangsmaterial für die Aluminiumgewinnung (Schmelzflusselektrolyse). Es wird darüber hinaus als Schleif- oder Poliermittel und für Uhrensteine, Ziehsteine und Düsen verwendet. In keramischer Form dient es als Isolierstoff, Konstruktionskeramik, als Substratmaterial für Dickschichtschaltkreise, als Grundplatte von Leistungshalbleitern und in transparenter Form als Entladungsgefäß von Natriumdampf-Hochdrucklampen.
- Aluminiumhydroxid Al(OH)3 wird ebenfalls nach dem Bayer-Verfahren gewonnen und ist das wichtigste Ausgangsmaterial zur Erzeugung anderer Al-Verbindungen, vor allem für Aluminate. Als reines Produkt wird es als Füllstoff und zum Brandschutz in Kunststoffen und Beschichtungen eingesetzt.
- Aluminiumchlorid, Polyaluminiumchlorid und Aluminiumsulfat werden vor allem als Flockungsmittel in der Wasseraufbereitung, Abwasserreinigung und der Papierindustrie eingesetzt.
- Natriumaluminat NaAl(OH)4 wird ebenfalls als Flockungsmittel verwendet und ist weiterhin Rohstoff für die Zeolith-Produktion, Titandioxid-Beschichtung und Calciumaluminatsulfat-Herstellung.
- Zeolithe (Alumosilikate) als Ionenaustauscher, in Lebensmitteln und in Waschmitteln zur Wasserenthärtung.
- Alaune (Kaliumaluminiumsulfat, KAl(SO4)2·12H2O). Wegen seiner adstringierenden Wirkung als Rasierstift eingesetzt zum Stillen von kleinen Blutungen.
- Aluminiumdiacetat, bekannt als essigsaure Tonerde für entzündungshemmende Umschläge.
- Aluminiumorganische Verbindungen wie etwa Triethylaluminium werden im großtechnischen Maßstab als Katalysatoren in der Polyethylen-Herstellung eingesetzt. Ein weiteres Anwendungsgebiet ist die Halbleitertechnik. Hier werden flüchtige Aluminiumalkyle (Trimethylaluminium, Triethylaluminium etc.) als Vorstufen zur CVD (chemical vapor deposition) von Aluminiumoxid verwendet, das man als Isolator und Ersatz für das nicht ausreichend isolierende Siliciumdioxid einsetzt.
- Bei der Aluminothermie wird Aluminium zur Gewinnung anderer Metalle und Halbmetalle verwendet (siehe auch Thermitverfahren).
- Aluminiumoxynitrid ist ein transparenter keramischer Werkstoff.
- Aluminiumnitrid ist ein Konstruktions- und Isolationswerkstoff und zeichnet sich durch sehr hohe Wärmeleitfähigkeit bei Raumtemperatur aus. Außerdem könnte die hohe Bandlücke die Anwendung als Wide-bandgap-Halbleiter ermöglichen.
- Lithiumaluminiumhydrid (LiAlH4) ist ein starkes Reduktionsmittel, welches weitverbreitet bei der Synthese organischer Verbindungen ist.
- Phosphate: Aluminiumphosphate sind Aluminiumsalze der Phosphorsäure. Aufgrund der Eigenschaft der Phosphorsäure beziehungsweise des Phosphat-Anions (PO43−), unter bestimmten Bedingungen Wasser abzuspalten und infolgedessen zu polymerisieren, sind verschiedene Aluminiumphosphate bekannt:
- Aluminiumorthophosphat (AlPO4)
- Aluminiummetaphosphat (Al(PO3)3)
- Monoaluminiumphosphat (Al(H2PO4)3)
- Aluminiumpolyphosphat
- In der Natur treten Aluminiumphosphate meist in Form von Doppelsalzen auf. Beispiele hierfür sind etwa der Wavellit (Al3(PO4)2(F, OH)3 · 5H2O) oder der Türkis, ein Mischphosphat aus Kupfer und Aluminium/Eisen: Cu(Al,Fe)6(PO4)4(OH)8 · 4 H2O.
Unter besonderen Bedingungen tritt Aluminium auch einwertig auf. Diese Verbindungen werden zur Gewinnung von hochreinem Aluminium genutzt (Subhalogeniddestillation).
- Sucralfat, ein medizinisch genutztes Aluminium-Salz von Saccharosesulfat.
Siehe auch
Literatur
- Luitgard Marschall: Aluminium. Metall der Moderne. Oekom, München 2008, ISBN 978-3-86581-090-8.
- PF Zatta, AC Alfrey: Aluminium Toxicity in Infant’s Health and Disease. (englisch), World Scientific Publishing, Singapur 1977, ISBN 981-02-2914-3.
Weblinks
- MATERIAL ARCHIV: Aluminium – Umfangreiche Materialinformationen und Bilder
- Newsseite des Gesamtverbands der Aluminiumindustrie
- aluMATTER – ein interaktives E-Learning-Tool über Aluminium Werkstoffkunde, Fertigung und Anwendungen, in vier Sprachen umschaltbar – daher auch gut geeignet als Fachwortlexikon
- Preis-Entwicklung des Rohstoffs Aluminium seit 1992
- Elektrochemische Experimente mit Aluminium
- Aluminium im menschlichen Körper
- Christopher Exley: Aluminium and Medicine, in Molecular and Supramolecular Bioinorganic Chemistry ISBN 978-1-60456-679-6, englisch, (pdf-Datei; 174 kB), zuletzt abgerufen Juni 2013
Einzelnachweise
- ↑ 1,0 1,1 Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
- ↑ IUPAC, Standard Atomic Weights Revised v2
- ↑ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: The Journal of Physical Chemistry A. 113, 2009, S. 5806–5812 (doi:10.1021/jp8111556).
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics, CRC Press LLC, 1998, ISBN 0-8493-0479-2.
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ Hollemann: A. F. Hollemann, Egon Wieberg: Lehrbuch der Anorganischen Chemie. 91-100 Auflage. Walter de Gruyter, Berlin New York 1985, ISBN 3-11-007511-3, S. 868.
- ↑ 8,0 8,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337 (doi:10.1021/je1011086).
- ↑ Joseph L. Rose: Ultrasonic Waves in Solid Media. Cambridge University Press, 2004, ISBN 978-0-521-54889-2, S. 44 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Tribikram Kundu: Ultrasonic and Electromagnetic NDE for Structure and Material Characterization. CRC Press, 2012, ISBN 1439836639, S. 94ff. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Aluminium. (Memento vom 14. Juli 2008 im Internet Archive) In: Baustoffsammlung der Fakultät für Architektur der TU München.
- ↑ Nicht-Eisen-Metalle. (PDF)
- ↑ 13,0 13,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 7429-90-5 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Datenblatt Aluminium bei AlfaAesar, abgerufen am 13. März 2011 (JavaScript erforderlich).
- ↑ Seit dem 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 16,0 16,1 world-aluminium.org: The Global Aluminium Industry 40 years from 1972 (PDF; 308 kB), abgerufen am 17. November 2013.
- ↑ Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- ↑ Norman N. Greenwood, Alan Earnshaw: Chemistry of the Elements (2nd ed.). Butterworth–Heinemann (1997), ISBN 0-08037941-9, S. 217.
- ↑ Mineral Species containing Aluminum (Al) auf Webmineral (englisch).
- ↑ Aluminium. In: John W. Anthony u. a.: Handbook of Mineralogy. Mineralogical Society of America, 2010 (englisch, PDF, 56,9 kB).
- ↑ Aluminium bei mindat.org (englisch)
- ↑ Eutektikum Aluminiumoxid/Kryolith
- ↑ Aluminium und Silizium: von der Lagerstätte bis zur Verwendung. S. 10 (PDF, Seminararbeit; 527 kB).
- ↑ 24,0 24,1 Matthias Dienhart: Ganzheitliche Bilanzierung der Energiebereitstellung für die Aluminiumherstellung. (PDF; 1,3 MB) Dissertation an der Rheinisch-Westfälischen Technischen Hochschule Aachen, Juni 2003, S. 7.
- ↑ Rainer Quinkertz: Optimierung der Energienutzung bei der Aluminiumherstellung, Dissertation, Rheinisch-Westfälische Technische Hochschule Aachen, 2002, Seiten 75-77
- ↑ World Mine Production, Reserves, and Reserve Base In: U.S. Geological Survey. (englisch, PDF; 87 kB).
- ↑ United States Geological Survey: World Smelter Production and Capacity (PDF-Datei; 87 kB)
- ↑ R.Feige, G.Merker:SEROX - ein synthetischer Al-Glasrohstoff
- ↑ Recycling ist nur der zweitbeste Weg, DER SPIEGEL 25/1993
- ↑ Udo Boin, Thomas Linsmeyer, Franz Neubacher, Brigitte Winter:Stand der Technik in der Sekundäraluminiumerzeugung im Hinblick auf die IPPC-Richtlinie, (Österreichisches) Umweltbundesamt, Wien, 2000, ISBN 3-85457-534-3, pdf-Datei
- ↑ Der Technologie-Leitfaden von ELB. In: Eloxalwerk Ludwigsburg.
- ↑ Was ist Gefahrgut im Passagiergepäck?, Website des Luftfahrt-Bundesamtes.
- ↑ Primary Aluminium. In: London Metal Exchange.
- ↑ Gesamtverband der Aluminiumindustrie e. V.: Meerwasserbeständigkeit von Aluminiumknetlegierungen. (PDF; 54 kB) Abgerufen am 29. März 2013.
- ↑ Bernd Leitenberger: Chemische Raketentreibstoffe Teil 1. In: Bernd Leitenbergers Web Site.
- ↑ Aluminium auf Feuerwerk-Wiki: www.feuerwerk.net
- ↑ Udo M. Spornitz: Anatomie und Physiologie. Lehrbuch und Atlas für Pflege- und Gesundheitsfachberufe. Springer, Berlin. 2010 ISBN 3-642-12643-X
- ↑ 38,0 38,1 Aluminium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2013.
- ↑ Wilfried Puwein:Das "Waldsterben" in Österreich und seine ökonomischen Folgen, (pdf-Datei; 792 kB)
- ↑ Hideaki Matsumoto: Cell biology of aluminum toxicity and tolerance in higher plants. In: International Review of Cytology. 200, 2000, S. 1–46, doi:10.1016/S0074-7696(00)00001-2.
- ↑ Bunichi Ezaki u. a.: Different mechanisms of four aluminum (Al)-resistant transgenes for Al toxicity in Arabidopsis. In: Plant Physiology. 127, Nr. 3, 2001, S. 918–927, PMID 11706174.
- ↑ Charlotte Poschenrieder u. a.: A glance into aluminum toxicity and resistance in plants. In: Science of The Total Environment. 400, Nr. 1–3, 2008, S. 356–368, doi:10.1016/j.scitotenv.2008.06.003.
- ↑ Sanjib Kumar Panda, Frantisek Baluska, Hideaki Matsumoto: Aluminum stress signaling in plants. In: Plant Signaling & Behaviour. 4, Nr. 7, 2009, S. 592–597, PMID 19820334. PMC 2710549 (freier Volltext).
- ↑ Bundesverband der Lebensmittelchemiker/-innen im öffentlichen Dienst e.V. (BLC): Aluminium in Lebensmitteln
- ↑ 45,0 45,1 45,2 Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact. Materials on a request from European Commission on Safety of aluminium from dietary intake. The EFSA Journal (2008).754, 1–34 http://www.efsa.europa.eu (PDF-Datei; 550 kB).
- ↑ Aluminium in Lebensmitteln: lebensmittel.org
- ↑ 47,0 47,1 47,2 Bundesinstitut für Risikobewertung (Hrsg.): Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen. 22. Juli 2007 (PDF-Datei; 106 kB).
- ↑ Efsa-Beratung zur Sicherheit von Aluminium in Lebensmitteln: http://www.efsa.europa.eu
- ↑ Aluminium in der Datenbank für Lebensmittelzusatzstoffe.
- ↑ Chemisches und Veterinäruntersuchungsamt Karlsruhe: Laugengebäck: Wie gelangt Aluminium in das Gebäck? 2004.
- ↑ H. Eschnauer: Die Verwendung von Aluminium in der Weinwirtschaft, Vitis, 1 (1958), S. 313–320, zitiert von S. 319, (pdf-Datei; 729 kB)
- ↑ in Müller, Dünnleder, Mühlenberg, Ruckdeschel: Legionellen – ein aktives Problem der Sanitärhygiene, expert-Verlag, 3. Auflage, ISBN 978-3-8169-2725-9 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Gitelman, H. J. "Physiology of Aluminum in Man", in Aluminum and Health, CRC Press, 1988, ISBN 0-8247-8026-4, S. 90 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ 54,0 54,1 Ferreira PC, Piai Kde A, Takayanagui AM, Segura-Muñoz SI: Aluminum as a risk factor for Alzheimer's disease. In: Rev Lat Am Enfermagem. 16, Nr. 1, 2008, S. 151–157. doi:10.1590/S0104-11692008000100023. PMID 18392545.
- ↑ Bundesinstitut für Risikobewertung (Hrsg.): Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. 26. Februar 2014 (PDF-Datei; 144 kB).
- ↑ Aluminium and Alzheimer's disease, The Alzheimer's Society. Retrieved 30 January 2009
- ↑ : Aluminum and Silica in Drinking Water and the Risk of Alzheimer's Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. 169, Nr. 4, 2008, S. 489–496. doi:10.1093/aje/kwn348. PMID 19064650. Volltext bei PMC: 2809081.
- ↑ : Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer's disease. In: Journal of Inorganic Biochemistry. 103, Nr. 11, 2009, S. 1579–1584. doi:10.1016/j.jinorgbio.2009.07.023. PMID 19744735.
- ↑ Aluminium-Industrie (Memento vom 2. Mai 2010 im Internet Archive) auf staufenbiel.de
- ↑ Hans Daxbeck, Adolf Merl, Eva Ritter, Paul H. Brunner: Analyse der Flüsse des lizenzierten Aluminiums in Österreich, Technische Universität Wien, Institut für Wassergüte und Abfallwirtschaft, 2000, pdf-Datei
- ↑ International Aluminium Journal, 6/2013, S. 81ff.
- ↑ The Economist: Case history: The truth about recycling
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase | unbekannt |
| Dieser Artikel basiert ursprünglich auf dem Artikel Aluminium aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |






+2\ OH^{-}(aq)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a732a2263125aca5df8ea80c46a7974bb87472cc)
+3\ e^{-}+2\ H_{3}O^{+}(aq)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6524b2768718ef36682d719c25015626f764b083)