| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Adenoviridae
| Adenoviridae | ||||||||
|---|---|---|---|---|---|---|---|---|
Adenoviridae | ||||||||
| Systematik | ||||||||
| ||||||||
| Taxonomische Merkmale | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| Adenoviridae (engl.) | ||||||||
| Links | ||||||||
|
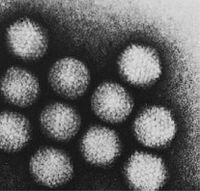
Die Familie Adenoviridae (von altgriechisch αδένας ‚Drüse‘) oder Adenoviren (Einzahl: Adenovirus) umfasst unbehüllte Viren mit einer doppelsträngigen, linearen DNA als Genom. Ihr Kapsid hat eine ikosaedrische Symmetrie und besitzt einen besonderen, die Virusfamilie charakterisierenden Aufbau aus so genannten Penton- und Hexon-Kapsomeren. An den Pentonen sind typische, antennenartige Fiberproteine verankert, die den Virionen der Familie ihr „satellitenartiges“ Erscheinungsbild geben. Die Familie beinhaltet derzeit 47 human- und tierpathogene Virusspezies mit zahlreichen Subtypen bei Säugetieren, Vögeln, Reptilien und Fischen. Beim Menschen verursachen die humanen Adenoviren überwiegend Erkrankungen der Atemwege.
Die ersten Adenoviren wurden 1953 von einer Arbeitsgruppe um Wallace P. Rowe und Robert J. Huebner aus Tonsillen und anderem adenoidem Drüsengewebe von Kindern isoliert und in einer Zellkultur vermehrt.[4] Diese unter anderem bei Erkältungskrankheiten vorgefundenen Viren wurden auch als Adenoidal-Pharyngeal-Conjunctival-Viren (APC-Viren) und Adenoid Degeneration Agents (A-D-Agents, im Deutschen AD-Agens) bezeichnet, da sie in adenoidem Gewebe nekrotische Veränderungen verursachen.[5] In der Geschichte der Molekularbiologie spielen die Adenoviridae eine bedeutende Rolle, da bei ihnen 1977 ein grundlegender Prozess der Genexpression entdeckt wurde, das so genannte Spleißen. In der Gentechnik und der virologischen Forschung sind Adenoviren für das Einschleusen von DNA als viraler Vektor in Zellen und Organismen von gewisser Bedeutung.
Morphologie
Die unbehüllten Kapside der Adenoviridae sind zwischen 70 und 90 nm im Durchmesser groß und bestehen aus 252 Kapsomeren. Von diesen Kapsomeren existieren zwei unterschiedliche Typen: 12 der sogenannten Pentone und 240 der Hexone. Die Hexone (8–10 nm) bestehen aus einem Trimer des Hexonproteins (Virusprotein II, Molekülmasse 120 kDa) und sind bei Mitgliedern der Gattung Mastadenovirus durch weitere hexonassoziierte Proteine an ihren Kontaktstellen stabilisiert (VP IX, X, XI). An der Innenseite der Hexone befinden sich zwei weitere Proteine (VP VI und VIII), die gleichzeitig mit Proteinen des innersten Nukleoproteinkomplexes interagieren. Das VP VI befindet sich in ringförmiger Anordnung nur an den fünf Hexonen, die jeweils um ein Penton gelagert sind.
Die Pentone befinden sich an den Ecken der ikosaedrischen Symmetrie (an den Achsenpunkten der fünfstrahligen Symmetrieachse) und bestehen aus einem Pentamer des Pentonbasisproteins (VP III, 80 kDa) und dem pentonbasisassoziierten Protein (VP IIIa, 66 kDa). An den Pentonen setzen die – je nach Spezies zwischen 9 und 77,5 nm langen – Fibern (spikes) an, die aus Trimeren des glykosylierten Fiberproteins (VP IV, 62 kDa) zusammengesetzt sind. Innerhalb der Gattung Aviadenovirus bestehen die Fibern aus zwei unterschiedlichen Fiberproteinen.
Das Fiberprotein vermittelt die Bindung an die Oberfläche der Wirtszelle und induziert die gruppenspezifischen Antikörper. Einen Nachteil von unbehüllten Viren gegenüber behüllten können die Adenoviren daher aufgrund der Fiberstruktur umgehen: Eine Anpassung an einen neuen Wirt oder eine neue Zielzelle (damit einem neuen Rezeptor) können unbehüllte Viren gewöhnlich nur durch Mutationen ihrer äußersten Kapsidproteine realisieren; diese Mutationen können jedoch zu einer Instabilität des Kapsids oder dem vollständigen Verlust seiner Verpackungsfähigkeit führen. Die Adenoviren haben hingegen die Möglichkeit, neue Varianten allein durch Mutationen der Fiberstrukturen zu entwickeln und das komplexe Kapsid unverändert beizubehalten.
Das Innere (Core) der Adenoviren ist von einem Nukleoproteinkomplex angefüllt, der aus dem doppelsträngigen, linearen DNA-Genom besteht, an das die basischen Proteine VP VII und X (bei der Gattung Mastadenovirus zusätzlich VP V) angelagert sind. Zusätzlich befindet sich an beiden 5’-Enden der dsDNA ein kovalent gebundenes Protein, das sogenannte Terminale Protein (TP).
Das Genom ist zwischen 26 und 45 kBp lang und enthält an beiden Enden repetitive Sequenzen, die so genannten ITRs (Inverted terminal repeats). Innerhalb der Familie ist der zentrale Anteil des Genoms, der überwiegend für die Strukturproteine des Kapsids codiert, sehr konserviert. Die Gattungen unterscheiden sich jedoch wesentlich in der DNA-Sequenz und deren Genprodukte an den Enden des Genoms.
Systematik
Die Systematik nach ICTV (Stand November 2018) beinhaltet u. a. folgende Spezies:
- Genus Atadenovirus[6]
- Genus Aviadenovirus[7]
- Fowl aviadenovirus A – E (Geflügeladenoviren) bei Gänse- und Hühnervöglen
- Goose aviadenovirus A bei Gänsen
- Duck aviadenovirus B bei Enten
- Pigeon aviadenovirus A und B bei Tauben
- Falcon aviadenovirus A bei Falken
- Psittacine aviadenovirus B bei Papageien
- Turkey aviadenovirus B bis D bei Truthühnern
- Genus Ichtadenovirus[8]
- Sturgeon ichtadenovirus A alias White sturgeon adenovirus beim Weißen Stör
- Genus Mastadenovirus
- Humanes Mastadenovirus A–F (HAdV-A bis HAdV-F) beim Menschen
- Bovine mastadenovirus A bis C bei Rindern
- Canine mastadenovirus A[9]
- Equine mastadenovirus A bei Pferden
- Ovine mastadenovirus A und B beim Schafen
- Porcine mastadenovirus A bei Schweinen
- Simian mastadenovirus A bei Affen
- Tree shrew mastadenovirus A bei Tupaias
- „Caprines Adenovirus“ (Goat adenovirus 2, GAdV-2) bei Ziegen[10]
- „Guinea Pig Adenovirus“ bei Meerschweinchen
- „Ovines Adenovirus C“ (Ovine adenovirus 6, OAdV-6) bei Schafen[10]
- Genus Siadenovirus[11]
- Frog siadenovirus A alias Froschadenovirus 1 bei Fröschen
- Great tit siadenovirus A bei Kohlmeisen
- Penguin siadenovirus A bei Pinguinen
- Raptor siadenovirus A bei Raubvögeln
- Skua siadenovirus A bei Raubmöwen
- Turkey siadenovirus A alias Truthahnadenovirus A beui Truthühnern
Schimpansen-Adenoviren: Aus Schimpansen isolierte Adenoviren werden aufgrund ihrer großen Ähnlichkeit mit bestimmten Humanen Adenoviren (HAdVs) in „menschliche“ Adenovirus-Arten klassifiziert. So gehören die Simian-Adenoviren SAdV-22 bis SAdV-25 zur Spezies Human-Mastadenovirus E und SAdV-21 zur Spezies Human-Mastadenovirus B.[12]
Ähnlichkeiten zu anderen Viren
Der Phage PRD1 (Familie Tectiviridae) zeigt in der Struktur des Kapsids und der Schwanzfibern auffällige Ähnlichkeiten mit Adenoviren. Auch die Anordnung einiger Gene auf dem Genom dieses Phagen (DNA-Polymerase, Terminales Protein) und das Vorhandensein zweier ITRs (Inverted terminal repeats) zeigt Analogien, was insgesamt auf einen stammesgeschichtlichen Zusammenhang mit den Adenoviren hindeutet.[13]
In Pflanzen und Pilzen findet sich, teils im Cytoplasma oder innerhalb der Mitochondrien, ein lineares Plasmid (z. B. das „Killer-Plasmid“ der Hefe), das eine ähnliche Anordnung der Gene für die ITRs, die Polymerase und das Terminale Protein zeigt.
Die Schwanzfibern vieler Mitglieder der Adenoviridae und das Coxsackievirus B nutzen den gleichen Rezeptor CAR (Coxsackie-Adenovirus-Rezeptor) zur Erkennung von Zielzellen. Darüber hinaus haben die adenoviralen Schwanzfibern strukturelle Ähnlichkeiten mit einem Anheftungsprotein innerhalb der Reoviridae.
Gentherapie
Humane Adenoviren (vor allem Typ 5 aus der Spezies C) sind ein im Labor weit verbreiteter gentherapeutischer Vektor. Vor allem in der Krebstherapie sollen die adenoviralen Vektoren zukünftig eingesetzt werden.[14]
Gesundheitliche Folgen beim Menschen
Humane Adenoviren verursachen eine Vielzahl von unterschiedlichen Erkrankungen. Die unterschiedlichen Spezies A–G der Adenoviren sind nicht eindeutig einem Krankheitsbild zuzuordnen. Die Erkrankungen, die durch humane Adenoviren ausgelöst werden, können von leichten bis schweren Atemwegsinfektionen, über disseminierte Infektionen bei immunsupprimierten Kindern, als auch Durchfälle sein. Vor allem ist das humane Adenovirus (Typ 19) bekannt dafür Keratokonjunctivitiden (Augenentzündung mit Beteiligung der Cornea) auszulösen.[15] Nach einer US-Studie soll das Adenovirus 36 menschliches Fettgewebe dazu veranlassen, sich in besonders große Fettzellen zu verwandeln, wodurch eine Dickleibigkeit hervorgerufen werden kann.[16][17]
Literatur
- M. B. Matthews, T. Shenk: Adenovirus virus-associated RNA and translational control. In: Journal of Virology, 65, 1991, S. 5657–5662.
- C. M. Fauquet, M. A. Mayo u. a.: Eighth Report of the International Committee on Taxonomy of Viruses. London / San Diego 2004.
- David M. Knipe, Peter M. Howley (Hrsg.): Fields’ Virology. 4. Auflage. Philadelphia 2001.
Einzelnachweise
- ↑ Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensICTVKoonin2019wurde kein Text angegeben. - ↑ Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensWalker2019wurde kein Text angegeben. - ↑ U. Krech in Lehrbuch der Medizinischen Mikrobiologie, 6. Auflage 1988, Gustav Fischer Verlag Stuttgart, Seite 640
- ↑ Hans von Kress (Hrsg.): Müller–Seifert. Taschenbuch der medizinisch-klinischen Diagnostik. 69. Auflage. Verlag von J. F. Bergmann, München 1966, S. 1062.
- ↑ SIB: Atadenovirus, auf: ViralZone
- ↑ SIB: Aviadenovirus, auf: ViralZone
- ↑ SIB: Ichtadenovirus, auf: ViralZone
- ↑ NCBI: Canine mastadenovirus A (species)
- ↑ 10,0 10,1 D. Raoult: Virus Taxonomy: Eighth Report of the International Committee on Taxonomy of Viruses, 2005: The Double Stranded DNA Viruses, (Mastadenovirus:) TENTATIVE SPECIES IN THE GENUS
- ↑ SIB: Siadenovirus, auf: ViralZone
- ↑ 9th report/dsdna-viruses-2011/w/dsdna viruses/93/adenoviridae ICTV 9th Report (2011): Adenoviridae (Link nicht mehr abrufbar)
- ↑ Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic: Origins and evolution of viruses of eukaryotes: The ultimate modularity. In: Virology, Mai 2015, S. 479–480. 2–25, Epub 12. März 2015, PMC 5898234 (freier Volltext), PMID 25771806
- ↑ H. Tazawa, S. Kagawa, T. Fujiwara: Advances in adenovirus-mediated p53 cancer gene therapy. In: Expert opinion on biological therapy. Band 13, Nummer 11, November 2013, ISSN 1744-7682, S. 1569–1583, doi:10.1517/14712598.2013.845662, PMID 24107178.
- ↑ J. P. Lynch, M. Fishbein, M. Echavarria: Adenovirus. In: Seminars in respiratory and critical care medicine. Band 32, Nummer 4, August 2011, ISSN 1098-9048, S. 494–511, doi:10.1055/s-0031-1283287, PMID 21858752 (Review).
- ↑ Übergewicht: Erkältungsvirus macht Kinder dick. In: Focus Online. 20. September 2010, abgerufen am 17. März 2015.
- ↑ H. N. Na, H. Kim, J. H. Nam: Prophylactic and therapeutic vaccines for obesity. In: Clinical and experimental vaccine research. Band 3, Nummer 1, Januar 2014, ISSN 2287-3651, S. 37–41, doi:10.7774/cevr.2014.3.1.37, PMID 24427761, PMC 3890448 (freier Volltext) (Review).
| Dieser Artikel basiert ursprünglich auf dem Artikel Adenoviridae aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |



